Vahva elektrolyyttikonsepti, ominaisuudet, esimerkit

- 4246
- 831
- Ronald Reilly
Eräs Vahva elektrolyytti Se on kaikki se aine, joka liuennut veteen tai tiettyyn liuottimeen, on täysin dissosioitunut ioneihin. Siksi neutraaleina molekyyleinä ei pitäisi olla liuosta tai liukenemattomia kiinteitä aineita. Vahva elektrolyytti voi olla suola, happo tai emäs, mikäli ne dissosioituvat tai kokonaan ioniset.
Edustavin esimerkki elektrolyytistä on yleinen suola, natriumkloridi, NaCl. Vesipitoisessa liuoksessa NaCl -kiteet dissosioituvat kokonaisuudessaan na -ionien tuottamiseksi+ ja cl-, Se päätyy ympäröiviin vesimolekyyleihin. Sitten sanotaan, että suola käyttäytyy kuin vahva elektrolyytti, kun sen liukoisuus on erittäin paljon vettä.
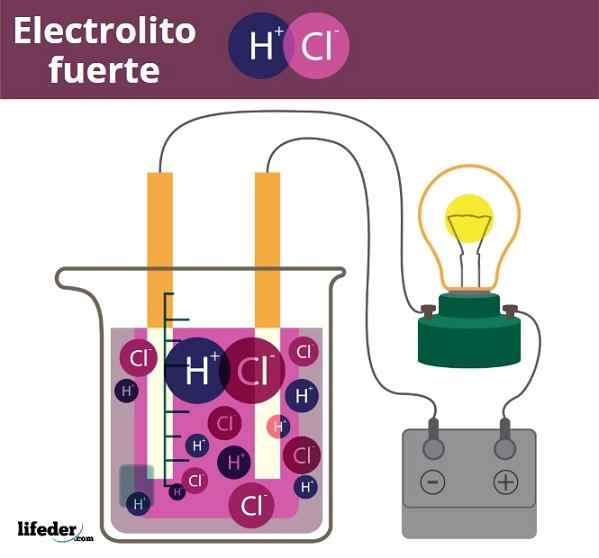 Fuero -elektroliittiesimerkki. HCL, suolahappo, vapauta H3O+ ja Cl -ionit-
Fuero -elektroliittiesimerkki. HCL, suolahappo, vapauta H3O+ ja Cl -ionit- Jonkin verran samanlainen on happojen ja emäksen tapaus. Kun nämä ovat vahvoja, niiden veden liuokset tuottavat enimmäismäärän H -ioneja3JOMPIKUMPI+ tai tai oh-, Joten pH -muutokset ovat äkillisiä. Esimerkkejä vahvoista hapoista ja emäksistä ovat typpihappo, HNO3, ja kaliumhydroksidi, KOH,.
On tärkeää tietää, kuinka tunnistaa vahvat elektrolyyttit valmistettaessa erittäin ionisia liuoksia tai erittäin vahvoja happoja tai emäksisiä keinoja.
[TOC]
Vahvojen elektrolyyttien ominaisuudet
Liukoisuus
Vahville elektrolyytteille on ominaista erittäin liukoinen vesijohto. Kiinteät tai kaasut, kun joutuu kosketuksiin veden kanssa, ei pitäisi viivästyä liikaa liukenemiseksi kokonaan. Jos esimerkiksi suola on vähän liukoinen veteen, voidaan hylätä vahvana elektrolyyttinä.
Ioninen johtavuus
Vahvat elektrolyytit eivät ole vain kovin liukenevia veteen, vaan myös tuottavat suuren määrän ioneja. Näiden ionien sähkömaksujen ansiosta elektronit voivat mukavasti kulkea ratkaisuja. Tämä heijastuu ionisen johtavuuden lisääntyessä puhtaan veden suhteen. Siksi ioniset ratkaisut johtavat erittäin hyvin sähköä.
Voi palvella sinua: Kloori: Historia, ominaisuudet, rakenne, riskit, käyttötarkoituksetSuolaliuoksen neutraalisuus
Monet suolaliuoksen vahvat elektrolyyttit, kun liukenevat veteen, eivät tuota pH -muutosta. Tämä tarkoittaa, että näiden suolojen liuokset eivät ole happamia tai emäksisiä, mutta neutraaleja, pH: n ollessa lähellä 7.
Siellä voi kuitenkin olla happoja tai emäksisiä suoloja, jotka ovat helposti liuenneet veteen ja jotka myös tuottavat täydelliset ionit. Esimerkiksi natriumkarbonaatti2Yhteistyö3, liukenee na -ionien tuottamiseksi+ ja yhteistyökumppani32-, Mutta liuoksen pH on emäksinen.
Esimerkkejä vahvoista elektrolyytteistä
 Natriumkloridi on edustavin esimerkki vahvasta elektrolyytistä. Lähde: Cristian V. /CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)
Natriumkloridi on edustavin esimerkki vahvasta elektrolyytistä. Lähde: Cristian V. /CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0) Vahvat elektrolyyttit, jotka ovat niin monia, on jaettu kolmeen luokitteluun: vahvat hapot, vahvat emäkset ja liukenevat suolat neutralointituotteet kahden ensimmäisen välillä.
Vahvat hapot
Vahvojen happojen, kun se on liukenevat veteen ilman ongelmia, on tuotettava enimmäismäärän H3JOMPIKUMPI+, Joten hapon on oltava täysin ionia; Eli sitä ei pitäisi olla neutraalina molekyylinä happoprotoneilla vapauttamatta.
Esimerkkejä näistä hapoista ovat:
-HCL, suolahappo, vapauttaa H -ionit3JOMPIKUMPI+ ja cl-
-HF, fluorhiahappo, vapauttaa H -ionit3JOMPIKUMPI+ ja f-
-Hno3, Typpihappo, vapauta hion h3JOMPIKUMPI+ ja ei3-
-Hclo4, perklorihappo, vapauttaa H -ionit3JOMPIKUMPI+ ja Clo4-
-Hio4, periódiinihappo, vapauttaa H -ionit3JOMPIKUMPI+ Ja io4-
-H2Sw4, rikkihappo, vapauta hion h3JOMPIKUMPI+ Ja niin42-
Syy, miksi hydrium -ioni, H3JOMPIKUMPI+, Se on aina läsnä (tavalla tai toisella), se johtuu siitä, että heidän lahjoittamansa vety saa vesimolekyylin:
HCL + H2O → h3JOMPIKUMPI+ + Cl-
Reaktio on suora ja peruuttamaton. Tämä on vahvan hapon ominaisuus, mikä puolestaan on vahva elektrolyytti sen täydellisen ionisaation takia vedessä.
Voi palvella sinua: alifaattiset hiilivedyt: ominaisuudet, nimikkeistö, reaktiot, tyypitVahvat tukikohdat
Vahvien emäksen, joka liukenee veteen ilman mitään ongelmia, on vapautettava OH -ionit- samoista kiteistä tai peruuttamattomasti virheellisestä vesimolekyylistä niiden tuottamiseksi.
Monet vahvat emäkset koostuvat ionista ja ei -molekyylisistä kiinteistä aineista. Joitakin esimerkkejä näistä emäksistä, jotka käyttäytyvät vahvoina elektrolyytteinä, ovat:
-Litiumhydroksidi, vapauttaa OH -ionit- ja Li+
-NaOH, natriumhydroksidi, vapauttaa OH -ionit- ja na NA+
-RBOH, Rubidio -hydroksidi, vapauttaa OH -ionit- ja RB+
-CA (OH)2, kalsiumhydroksidi, vapauta OH -ionit- ja CA2+
-SR (OH)2, Strontiumhydroksidi, vapauta OH -ionit- ja herra2+
-Ba (OH)2, Bariumhydroksidi, vapauta OH -ionit- ja ba2+
-Nah, natriumvesidi, vapauttaa OH -ionit- ja vetykaasu, H2
-Nanh2, Natrium amiduro, vapauta OH -ionit- ja ammoniakkikaasu, NH3
Menet ulos
Hallobasi Strong Elektrolyyttit vedessä liukeneessa on oltava täysin ionia. Monet heistä eivät tuota pH -muutoksia. Tämä johtuu siitä, että heidän ionit ovat erittäin vakaita, joten he eivät osallistu hydrolyysitasapainoihin veden luonteen muuttamiseksi. Esimerkkejä näistä suoloista ovat:
-NaCl, natriumkloridi, vapauttaa Na -ionit+ ja cl-
-Agno3, Hopea -nitraatti, vapauta ag -ionit+ ja ei3-
-Vanhempi veli3, Natriumnitraatti, vapauta na -ionit+ ja ei3-
-K -k -2Sw4, Kaliumsulfaatti, vapauttaa K -ionit+ Ja niin42-
-Mgcl2, Magnesiumkloridi, vapauttaa Mg -ionit2+ ja cl-
-Cuso4, Kupari sulfaatti, vapauttaa ionit Cu2+ Ja niin42-
-KBR, kaliumbromidi, vapauttaa K -ionit+ ja br-
-Nh4Cl, ammoniumkloridi, vapauttaa NH -ionit4+, Cl-, H3JOMPIKUMPI+ ja ammoniakkikaasu
Se voi palvella sinua: elohopeakloridi (ii): rakenne, ominaisuudet, hankkiminen, käyttö-NACN, natriumsyanidi, vapauttaa Na -ionit+ ja CN-
-Naa3Poikki4, Natriumfosfaatti, vapauttaa Na -ionit+ ja Po43-
-CRCL3, Kromikloridi, vapauttaa cr -ionit3+ ja cl-
-Aub3, Aurinen bromidi, vapauttaa AU -ionit3+ ja br-
-Snso4, Estany -sulfaatti, vapauttaa SN -ionit2+ Ja niin42-
NH4CL on ristiriitainen esimerkki: se on täysin ionisoitu, mutta samalla se tuottaa ammoniakki -neutraaleja molekyylejä, koska se on happama suola.
Erot vahvan ja heikon elektrolyytin välillä
Vaikka erot heikon voimakkaan elektrolyytin välillä on todettu epäsuorasti, ne esitetään jäljempänä johtopäätöksenä:
-Vahvat elektrolyytit ovat hyvin liukoisia vesillä; Heikot elektrolyyttit eivät ole.
-Heikon elektrolyytin ionisaatio on osittainen, mikä tarkoittaa, että liuoksessa voi olla neutraaleja molekyylejä. Sen sijaan vahvoja elektrolyyttejä on yksinomaan ioneina.
-Heikot hapot ja emäkset, jotka puolestaan ovat heikkoja elektrolyyttejä, eivät dissosioi itseään kokonaan vedessä, joten ne tuottavat vähemmän ioneja H3JOMPIKUMPI+ tai tai oh- Mitä voidaan odottaa.
-Palth -halin vahvat elektrolyyttit eivät melkein hydrolysoitu verrattuna heikkoihin elektrolyytteihin. Siksi entisen liuokset ovat yleensä neutraaleja, paitsi silloin, kun ne käsittelevät happoa tai perussuolaa.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2020). Vahva elektrolyytti. Haettu: vuonna.Wikipedia.org
- Helmestine, Anne Marie, PH.D -d. (11. helmikuuta 2020). Vahva elektrolyytin määritelmä ja esimerkki. Toipunut: Admingco.com
- Chung & Chieh. (5. kesäkuuta 2019). Elektrolyyttit. Kemian librettexts. Palautettu: Chem.Librettexts.org
- « Ulkoiset arviointiominaisuudet, tyypit (testit), esimerkkejä
- Platonin elämäkerta, filosofia ja panokset »

