Heikko elektrolyyttikonsepti, ominaisuudet, esimerkit
- 3149
- 621
- Ronald Reilly
Eräs Heikko elektrolyytti Veteen liukenevaa ainetta ei ole täysin ionisoitu kokonaan. Tämä tarkoittaa, että sen liukeneminen tuottaa tai vapauttaa pienempiä ioneja kuin voitaisiin odottaa. Tämä ionisointiprosessi vahvistetaan hydrolyysitasapainolla, jossa ionit, kuten h, muodostetaan3JOMPIKUMPI+ tai tai oh-.
Heikot elektrolyyttit ovat yleensä kovalenttisia yhdisteitä, joiden molekyylit pysyvät yleensä neutraaleina saamatta ionisia kuormia. Monet näistä elektrolyyteistä koostuvat orgaanisista molekyyleistä, joilla on ionisoituvia funktionaalisia ryhmiä, vaikkakin on myös epäorgaanisia tyyppejä, mukaan lukien useita oksasideja.

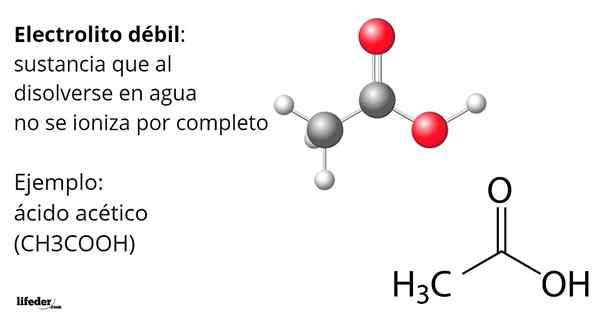
Etikkahappo, CHO3COOH, on esimerkki heikosta elektrolyytistä. Sen molekyylillä on funktionaalinen ryhmä, joka karakterisoi sen happamuutta vedessä. Kuitenkin, kun kaikki sen molekyylit eivät ole liuenneet, tuotanto -ioneja3JOMPIKUMPI+ muuntaminen asetaatianionissa, CHO3Kujertaa-, mutta ne ovat neutraaleja, protonettuna.
Jotkut elektrolyyttit ovat heikompia kuin toiset, mikä riippuu heidän ionisaatioiden asteesta. Kun ne liukenevat, ne aiheuttavat kohtalaisia muutoksia pH: ssa. Siten meillä on happamia tai emäksisiä heikkoja elektrolyyttejä.
[TOC]
Heikkojen elektoliittien ominaisuudet
Ne ovat kovalenttisia yhdisteitä
Yleisesti ottaen heikot elektrolyytit ovat kovalenttisia yhdisteitä, joten niiden rakenneyksiköt ovat molekyylejä.
He kärsivät hydrolyysistä
Näillä molekyyleillä on kyky hankkia ionisia kuormia. Tätä varten osallistu hydrolyysitasapainoon, jossa vesimolekyyli on "osa" OH-, tai hyväksy vety transformiksi h: ksi3JOMPIKUMPI+.
Mitä vähemmän todennäköinen tai epävakaa on hydrolyysi, sitä pienempi näiden elektrolyyttien liukenemisessa olevien ionien määrä tai pitoisuudet.
Heillä on alhainen johtavuus
Heikkojen elektrolyyttien ratkaisut eivät ole niin hyviä sähkönjohtimia verrattuna vahvojen elektrolyyttien ratkaisuihin. Tämä johtuu juuri sen pienimmistä ioneista liuoksessa, mikä vaikeuttaa elektronien läpäisemistä veden läpi.
Se voi palvella sinua: mangaaninen tai permanganiinihappoEsimerkkejä heikkoista elektrolyytteistä
 Apple -etikan etikkahappo on edustava esimerkki heikosta elektrolyytistä. Lähde: Pxhere.
Apple -etikan etikkahappo on edustava esimerkki heikosta elektrolyytistä. Lähde: Pxhere. Hiilihappo
Hiilihappomolekyyli, H2Yhteistyö3, Kun liukenevat veteen, seuraava hydrolyysireaktio kärsii:
H2Yhteistyö3 + H2Tai ⇌ HCO3- + H3JOMPIKUMPI+
Ongelmana on, että kaikki h ei2Yhteistyö3 Se on ionisoitu HCO: ssa3-. Lisäksi h2Yhteistyö3 Se on suhteeton hiilidioksidissa ja vedessä, mikä edelleen vähentää tämän liuoksen johtavuutta.
Jäljellä oleville esimerkeille tämä tosiasia on toistuva: molekyyli, joka on periaatteessa neutraali, saa ionisen kuormituksen ja hydrolyysin välittämässä prosessissa ioneja H on H -3JOMPIKUMPI+ tai tai oh-.
AmoniaYllyttääAc
Ammoniakkimolekyyli, NH3, Kun liukenevat veteen, seuraava hydrolyysireaktio kärsii:
Nh3 + H2Tai ⇌ NH4+ + vai niin-
Nämä ammoniakkiliuokset ampuvat terävää hajua.
Tällä kertaa meillä on OH -ionit-. Ammoniakki on heikko emäs, kun taas hiilihappo, heikko happo. Siksi hapot ja heikot emäkset luokitellaan heikkoiksi elektrolyytteiksi, koska ne on osittain ionisoitu vapauttamatta korkeita pitoisuuksia H H3JOMPIKUMPI+ tai tai oh-, vastaavasti.
-LlaFOSF -happojompikumpirikas
Fosforihappo, H3Poikki4, Se on esimerkki heikoista oksoasidista, joka puolestaan on elektrolyytti:
H3Poikki4+ H2Tai ⇌ h2Poikki4- + H3JOMPIKUMPI+
Fosforihappo kykenee edelleen kärsimään kahdesta muusta dissosiaatiosta, yksi kutakin happea vety (yhteensä kolme). H: n pitoisuus3JOMPIKUMPI+ Tuotettu on pienempi verrattuna vahvaan oksoacidiin, kuten typpihappo, HNO3, mikä on vahva elektrolyytti. Mitä heikompi elektrolyytti, sitä vähemmän hapan tai emäksinen se on.
HydjompikumpiGeno
Vetyfluoridi, HF, on esimerkki epäorgaanisesta kovalenttisesta yhdisteestä, joka ilman oksoasidia on heikko elektrolyytti, koska se on heikko happo. Kun liuotetaan vettä, tuotetaan fluoriahappo, joka on osittain ionisoitu:
Voi palvella sinua: koboltihydroksidiHF+ H2Tai ⇌ f- + H3JOMPIKUMPI+
Huolimatta siitä, ettei ole vahva elektrolyytti, fluoridihappo pystyy “syömään” materiaalien lasia.
Pyridiini
Pyridiini, c5H5N, on amiinia, joka on hydrolysoitu ionien muodostamiseksi OH--
C5H5N + h2Tai ⇌ c5H5Nh + + vai niin-
Pyridiini on emäksisempi kuin ammoniakki, joten sen ionisaatio on suurempi ja tuottaa siksi suurempia pitoisuuksia OH -ioneja-.
-LlaCianhihappoYllyttääDrico
Syanhydric -happo, HCN, on myös toinen esimerkki heikoista happosta ja elektrolyytistä:
HCN + H2Tai ⇌ CN- + H3JOMPIKUMPI+
Liukenemattomat suolat
Tämä kohta on kiistanalainen. Toistaiseksi heikot elektrolyytit on luokiteltu heikkoiksi hapoiksi tai emäksiksi, joille on ominaista niiden osittaiset ionisaatiot. Kuitenkin liukenemattomia suoloja vedessä, jotka ovat jo ionisoituneita kiteissä, on kuitenkin pidetty heikkona elektrolyytteinä.
Kun liukenevat vettä vaikeuksiin, liuoksessa vapautuvien ionien määrä on pieni verrattuna liukoisiin suoloihin. Tässä mielessä liukenemattomat suolat tuottavat vähemmän johtavia ratkaisuja, jotka varjostavat ne hiukan vahvoina elektrolyytteinä.
Tästä syystä tässä oletetaan, että nämä suolat kuuluvat heikkoon elektrolyyttiryhmään, jopa silloin, kun liuentavat tuottavat neutraaleja ioneja ja neutraaleja molekyylejä, joilla on ionisaatioaste.
Hopeakloridi
Hopeakloridi, AgCl, liukenee veteen tuottamaan ag -ioneja+ ja cl-. Se on kuitenkin melko liukenematon suola. Vapautuvien ionien määrä on paljon pienempi kuin mitä olisi, jos se olisi täysin liukoinen, kuten hopea -nitraatti, Agno3, Vahva elektrolyytti.
Voi palvella sinua: hajautettu vaiheKalsiumkarbonaatti
Kalsiumkarbonaatti, Caco3, Se on liukenematon suola, joka liuottamalla osittain tuottaa Ca -ioneja2+ ja yhteistyökumppani32-. Tämä suola, toisin kuin AGCL, on perusta, koska CO32- on hydrolysoitu ionien tuottamiseksi OH-.
Sinkkisulfaatti
Sinkkisulfaatti, Zonso4, Se on osittain liuennut veteen Zn -ionien tuottamiseksi2+ Ja niin42-.
Kalsiumfluori
Kalsiumfluori, CAF2, Luonnollisesti fluoriitti mineraalina se liukenee vain veteen tuottamaan Ca -ioneja2+ ja f-.
Magnesiumoksidi
Magnesiumoksidi, MGO, on melko liukenematon ioninen yhdiste vedessä. Pieni osa, joka liukenee2, joka on todellinen vastuussa Mg -ionien ulkonäöstä2+ ja oh-.
Siksi MGO: ta, huolimatta ionisesta, ei voida luokitella vahvaksi elektrolyytiksi, koska vedessä se ei vapauta omien kiteiden ioneja (MG2+ Minä2--A.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Chung & Chieh. (5. kesäkuuta 2019). Elektrolyyttit. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Helmestine, Todd. (11. helmikuuta 2020). Heikko elektrolyytin määritelmä ja esimerkki. Toipunut: Admingco.com
- Danielle Reid. (2020). Heikko elektrolyytti: Määritelmä ja esimerkki. Opiskelu. Toipunut: Opiskelu.com
- « Girondinos -tausta, joka olet sinä ja johtajat
- Ominaisuudet vino kolmiot, esimerkit, harjoitukset »

