Sisäiset elektronit

- 1380
- 156
- Shawn Stanton II
Selitämme, mitkä sisäiset elektronit ovat, niiden ominaisuudet ja annamme useita esimerkkejä
Mitkä ovat sisäiset elektronit?
Aina kun ajattelemme atomia, kuvittelemme protonien ja neutronien muodostaman ytimen, jota ympäröivät sen ympärillä pyörivät elektronit, samanlainen kuin kuinka planeetat pyörivät auringon ympärillä.
Mutta kaikki elektronit eivät ole samoja, ja kaksi luokkaa voidaan erottaa riippuen siitä, kuinka lähellä tai kaukana ne ovat atomiykkeistä.
Jotkut ovat kauempana ytimestä ja niitä kutsutaan Valencia -elektroneiksi. Nämä ovat vastuussa kaikista tunnetuista kemiallisista reaktioista. Toisaalta, Ne, jotka ovat lähinnä ydintä ja ovat siihen voimakkaammin yhdistyneitä, kutsutaan sisäisiksi elektroneiksi.
Sisäisten elektronien ominaisuudet
Ne ovat vakaimpia elektroneja
Yleensä, mitä alhaisempi elektronin energiataso, tämä on vakaampi. Sisäiset elektronit miehittävät kiertoradat atomin alimmilla energiatasoilla, siksi ne ovat myös vakaimpia elektroneja.
He ovat voimakkaammin yhdistyneitä ytimeen
Ytimet houkuttelevat elektroneja, koska molemmilla on vastakkaiset kuormat: ydin on positiivinen, kun taas negatiiviset elektronit. Tämä voima kasvaa etäisyyden laskiessa.
Tämän seurauksena sisäiset elektronit, jotka ovat lähinnä ydintä, ovat myös niitä, jotka ovat voimakkaimmin yhteydessä samaan. Samasta syystä ne ovat myös vaikeimpia elektroneja.
Ne eivät ole osa kemiallisia sidoksia
Kun yksi atomi lähestyy toista, ensimmäinen koskettava asia on heidän ulottuvat elektronit. Tästä syystä vain Valencia -elektronit puuttuvat kemiallisiin reaktioihin. Sisäiset elektronit eivät osallistu kemiallisiin sidoksiin, eivätkä ne ole mukana missään kemiallisessa reaktiossa.
Se voi palvella sinua: kuinka monta asiakaselektronia hiilellä on?Ne ovat hyvin suojauksia
Tämä tarkoittaa, että sisäiset elektronit seisovat ulkoisten elektronien ja ytimen välillä, mikä luo eräänlaisen näytön, joka vähentää voimaa, jolla ydin houkuttelee valenssin elektroneja.
He tulevat aina pareittain
Jokaisessa kiertoradalla on vain kaksi elektronia, joilla on vastakkaisia pyöriä, joita kutsutaan parillisiksi elektroniksi (mikä on toinen tapa sanoa, että ne muodostavat pari). Kuten orbitaalit, joissa sisäiset elektronit sijaitsevat, ne ovat aina täysin täynnä, joten nämä elektronit ovat aina parillisia.
Mistä tiedämme kuinka monta sisäistä elektronia atomilla on?
Tietäen, kuinka monella sisäisella elektronilla on atomi, on hyvin yksinkertaista. Sinun on vain tiedettävä, kuinka monta elektronia atomilla on ja kuinka monta näistä elektronista kuuluu Valencia -kerrokseen. Kaikki muut elektronit ovat sisäisiä elektroneja.
Mutta miten saamme selville nämä numerot? Seuraavissa osissa selitämme sen.
Elektronien kokonaismäärä on yhtä suuri kuin atomiluku
Koska atomit ovat neutraaleja (ts. Niissä ei ole nettovarausta), niillä on oltava sama määrä positiivisia kuormituksia (protoneja) kuin negatiiviset kuormat (elektronit). Kuten atomiluku osoittaa, kuinka monta protonia on ytimessä, niin se osoittaa myös kuinka monta elektronia atomi on noin, kun se on neutraali.
Ionien tapauksessa, jolla toisin kuin atomeilla on sähkövaraus, elektronien kokonaismäärä saadaan vähentämällä atomiluku paitsi ionikuormitus, kaikella ja niiden merkkillä.
Esimerkit
- Hiiliatomi (C) on jaksollisen taulukon elementti 6 (eli sen atomiluku). Siksi hiiliatomilla on yhteensä 6 elektronia.
- Natriumioni (i) (na+) on positiivinen varaus +1, ja atomien määrä natriumia on 11. Joten tämän ionin elektronien kokonaismäärä on: 11 - (+1) = 10 elektronia.
- Kloridi -ioni (CL-) on negatiivinen kuorma -1, ja kloorin atomi lukumäärä on 17. Joten tämän ionin elektronien kokonaismäärä on: 17 - ( - 1) = 17 + 1 = 18 elektronia.
Valencian elektronien lukumäärä on yhtä suuri kuin heidän ryhmänsä jaksollisessa taulukossa
Ryhmään 1A (alkalimetallit) kuuluvilla elementeillä on kaikissa 1 Valencian elektronia. Toiseen (alkineriin) kuuluvilla on 2, kolmannen (Boro -ryhmä, alumiini, gallium jne.) Heillä on 3 ja niin edelleen. Tämä ei koske siirtymämetalleja.
Kuten aikaisemmin, ionit vähennetään laskemalla niiden valenssielektronit.
Esimerkit
- Happi kuuluu ryhmälle 6a sille, jolla on 6 valenssielektronia.
- Sulfidi -ioni (S2-) Se kuuluu myös ryhmään 6a, mutta sen kuorma on -2, joten sillä on: 6 -( -2) = 6 + 2 = 8 Valencia -elektronia.
Esimerkkejä eri atomista ja niiden sisäisistä elektroneista
Sisäiset hiilielektronit (c)

Kuten hetki sitten näimme, hiilellä on yhteensä 6 elektronia. Lisäksi se kuuluu ryhmälle 4A, jolla on 4 Valencian elektronia, joten sillä on yhteensä 6 - 4 = 2 sisäistä elektronia.
Sisäiset typpielektronit (n)
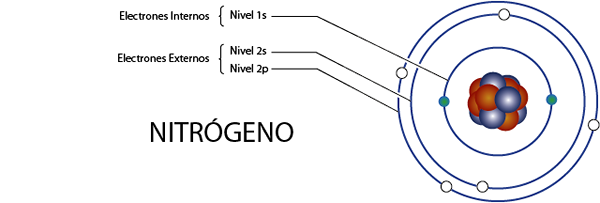
Typpellä on yhteensä 7 elektronia. Lisäksi se kuuluu ryhmälle 5A sille, jolla on 5 Valencian elektronia, joten sillä on yhteensä 7 - 5 = 2 sisäistä elektronia.
Argonin sisäiset elektronit (AR)
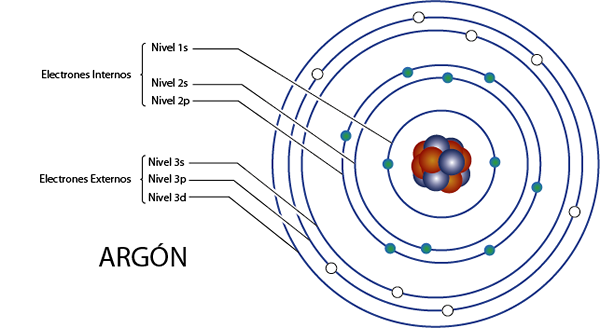
Argon on elementti 18, sillä on yhteensä 18 elektronia. Lisäksi se kuuluu ryhmään 8A, jolla on 8 Valencian elektronia, joten sillä on yhteensä 18 - 8 = 10 sisäistä elektronia.
Kloridi -ionin sisäiset elektronit (Cl--A
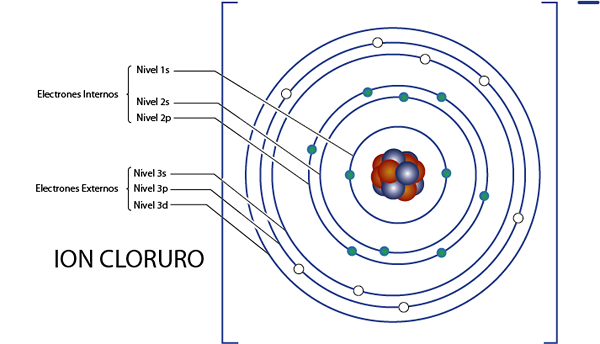
Kuten hetki sitten näimme, kloridilla on yhteensä 18 elektronia. Lisäksi se kuuluu ryhmään 7a ja siinä on kuorma -1, joten siinä on 7 - ( - 1) = 8 Valencia -elektronia. Joten sillä on 18 - 8 = 10 sisäistä elektronia, Kuten Argon.
Se voi palvella sinua: ydinkemia: historia, opintokenttä, alueet, sovelluksetKalsium +2 -ionin sisäiset elektronit (CA2+-A
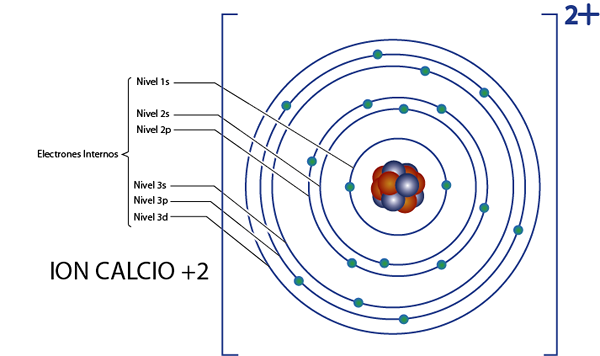
Kalsium on elementti 20, ja tällä ionilla on 2 positiivista varausta, joten sillä on yhteensä 20 - 2 = 18 elektronia ytimen ympärillä. Tämä elementti kuuluu ryhmään 2a ja koska sen kuorma on +2, niin siinä ei ole valenssielektroneja (2 - 2 = 0). Tästä syystä kaikki kalsiumin jäljellä olevat 18 elektronia ovat alun perin sisäisiä elektroneja.
On kaksi elementtiä, joilla ei ole sisäisiä elektroneja
Jaksollisen taulukon kahdella kevyemmällä elementillä, jotka ovat vetyä (H) ja heliumia (He), on vain 1 ja 2 elektronia. Molemmat elektronit ovat ainoan energiatasolla, joka näillä atomilla on, mikä on taso 1.
Tästä syystä nämä elektronit vastaavat näiden kahden elementin valenssielektroneja. Koska energiatasoja ei ole alhaisempia, silloin ei ole sisäisiä elektroneja.

