Enantiomeerit
- 2742
- 794
- Shawn Stanton II
Selitämme, mitkä enantiomeerit ja kiraalisuus, niiden ominaisuudet, nimikkeistö ja useita esimerkkejä ovat
 Nämä kaksi yhdistettä ovat enantiomeerejä, koska ne muodostuvat samoilla atomeilla, yhdistyneet samalla tavalla ja ovat spekulaarisia kuvia toisistaan
Nämä kaksi yhdistettä ovat enantiomeerejä, koska ne muodostuvat samoilla atomeilla, yhdistyneet samalla tavalla ja ovat spekulaarisia kuvia toisistaan Mitkä ovat enantiomeerit?
Se enantiomeerit Ne ovat yhdisteitä, jotka eivät ole overlampialeita peilikuvia toisistaan. Nämä yhdisteparit ovat tietyntyyppisiä isomeerejä, ts. Ne ovat erilaisia yhdisteitä, joilla on sama molekyylikaava.
Isomeerejä on erityyppisiä, joiden joukossa on stereoisomeerejä, joissa kaikki atomit yhdistyvät samassa järjestyksessä ja samantyyppisissä linkeissä, mutta niillä on erilaiset avaruudet (stereo tarkoittaa tilaa).
Stereoisomeereistä löydämme enantiomeerit, joiden pääominaisuuden on oltava spekulaarisia kuvia toistensa kanssa.
Enantiomeerit ovat luonteeltaan hyvin yleisiä. Itse asiassa melkein kaikki orgaaniset yhdisteet, jotka ovat läsnä kaikkien elävien olentojen soluissa, ovat yksi kahdesta mahdollisesta enantiomeeristä.
Esimerkiksi kaikki luonnollisiin proteiineihin osat aminohapot vastaavat vastaavan aminohapon enantiomeeriä L (toinen isomeeri tunnistaa D -kirjaimella).
Toisaalta valtaosan lääkkeiden aktiiviset aineosat ovat myös enantiomeerien parina, joista vain yksi on tehokas. Enantiomeerien erottamisvaikeus toisistaan tarkoittaa, että ne lääkkeet, jotka sisältävät vain hyödyllistä isomeeriä.
Enantiomeerit ja kiraalisuus
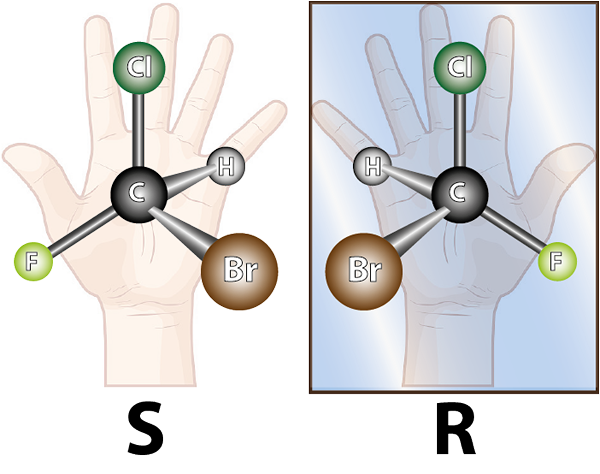
Enantiomeerit muodostuvat kiraalisilla molekyyleillä. Kiraliteetti on ominaisuus, että se ei ole päällekkäinen sen peilikuvan kanssa. Sana kiraali tulee kreikkalaisesta termistä, Kheir Mikä tarkoittaa kättä, muistaen sen tosiasian, että kädet ovat myös toisistaan spekulaarisia kuvia, ja ne eivät voi olla päällekkäisiä.
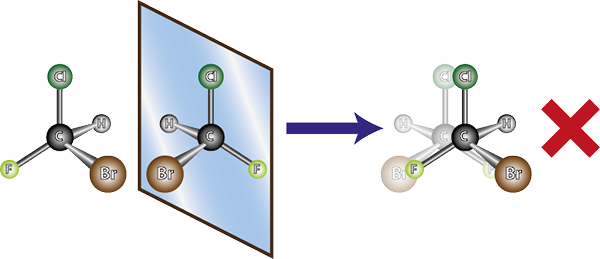 Vasemmanpuoleinen molekyyli on kiraalinen, koska kun sitä verrataan peilikuvaan, voidaan nähdä, että ne eivät ole päällekkäisiä. Toisin sanoen, ei ole mitään keinoa kiertää tai kääntää sitä siten, että kaikki atomit ovat samat toisiaan
Vasemmanpuoleinen molekyyli on kiraalinen, koska kun sitä verrataan peilikuvaan, voidaan nähdä, että ne eivät ole päällekkäisiä. Toisin sanoen, ei ole mitään keinoa kiertää tai kääntää sitä siten, että kaikki atomit ovat samat toisiaan Edellä esitetyn vuoksi voidaan päätellä, että jokaiselle kiraaliselle molekyylille on oltava toinen kiraalinen molekyyli, joka ei ole päällekkäinen peilikuva, ts. Toisin sanoen aina kun molekyylin sanotaan.
Voi palvella sinua: neodyymi: rakenne, ominaisuudet, käytötKiralkeskukset
Monilla kiraalisilla yhdisteillä on yksi tai useampi epäsymmetrinen keskukset, jotka ovat vastuussa molekyylin kiraalisuudesta. Näitä kutsutaan kiraalikeskuksiksi ja monissa orgaanisissa yhdisteissä koostuvat hiiliatomista, jotka on kytketty 4 atomiin tai eri atomien ryhmiin.
Erityinen muoto, koska nämä neljä ryhmää jakautuvat epäsymmetrisen hiilen ympärille, määrittelee, mikä kahdesta enantiomeeristä vastaa kiraalista molekyyliä. Yhden quiral -keskuksen läsnäolo varmistaa, että molekyyli on kiraalinen, mutta jos niitä on enemmän kuin yksi, se voi olla kiraalista, koska se ei välttämättä.
Enontiomer -ominaisuudet
Useimmat fysikaaliset ja kemialliset ominaisuudet ovat identtisiä
Kuten oikea käsi ja vasen käsi, enantiomeerit tulevat vain pareittain. Nämä yhdisteet ovat käytännössä identtisiä toistensa kanssa. Itse asiassa suurin osa sen fysikaalisista ja kemiallisista ominaisuuksista, kuten fuusion, kiehumisen, höyrynpaine ja liukoisuus joissakin liuottimissa, ovat identtisiä.
Optinen toiminta
Kaikilla kiraalisilla yhdisteillä on ainutlaatuinen ominaisuus, joka erottaa ne niistä, jotka eivät ole: heillä on kyky kiertää polarisoidun valon tasoa. Tätä ominaisuutta kutsutaan Optinen toiminta, Ja se on yksi harvoista ominaisuuksista, jotka erottavat kiraalisen yhdisteen sen enantiomeeristä.
Jälkimmäinen johtuu tosiasiasta, että polarisoitua valotasoa voidaan kiertää kahdesta suunnasta joko kellon neulojen suuntaan (nimeltään Dextrogyr ja esitetään +-symbolilla) tai kelloneuloja vasten (Levógiro, esitetty kanssa. Symboli -).
Jos quiral -yhdiste pyörittää polarisoitua valon tasoa yhteen suuntaan, sen enantiomeeri kääntää sen vastakkaiseen suuntaan.
-
Esimerkki
D-glucosa-liuos pyörittää polarisoitunutta valotasoa kelloneulojen suuntaan (oikealle, se on dekstrogyristä), kun taas L-glykoosiliuos saa sen kiertymään vastakkaiseen suuntaan.
Se voi palvella sinua: Erlenmeyer -pullo: ominaisuudet, käytöt, käyttötavatDifferentiaalinen reaktiivisuus
Toinen ominaisuus, joka sallii yhden enantiónin erottamisen toisesta, on sen reaktiivisuus muita kiraalisia yhdisteitä vastaan.
Differentiaalireaktiivisuutta voidaan verrata tapaan, jolla hansikka näyttää vain hyvältä toisessa kädessä, mutta ei toisessa tai oikeana kenginä sopii hyvin oikealle jalkaan, mutta ei vasemmalle.
Erilaisten reaktiivisuuden tärkeä seuraus on erilaiset vaikutukset, jotka voivat aiheuttaa joidenkin lääkkeiden kaksi enantiomeeriä. Nämä erot voivat olla vaarattomia, mutta ne voivat myös olla erittäin vaarallisia.
-
Esimerkit
- Aspartaamin kahdesta enantimeeristä (joka on keinotekoinen makeutusaine), toinen on makea, kun taas toisella ei ole makua.
- Vain omepratsolin enantiomeerit ovat tehokkaita mahalaukun suojana, kun taas toinen ei tuota mitään vaikutusta.
- D-penikilamiini on lääkitys nivelreumaa vastaan, kun taas sen enantiomeeri, L-penikilamiini on vaarallinen myrkky.
Differentiaalinen imeytyminen
Enantiomeerit eroavat myös siitä, miten ne imeytyvät hartsiin tai kiinteisiin aineisiin, jotka ovat myös kiraaleja. Enantiomeerien seos voidaan erottaa, jos se johdetaan kiraalisen erotuksen pylvään läpi, koska toinen kahdesta enantiomeeristä imeytyy voimakkaammin kuin toinen.
Enantiomeerien nimikkeistö
Yhden tai toisen enantiomeerin tunnistamiseksi on useita menetelmiä, mutta eniten käytettyjä on Cahn-ingold-prelog (CIP) -järjestelmä (CIP). Tämä koostuu seuraavista vaiheista:
- Hierarkiataso on osoitettu neljään ryhmään, jotka on kiinnitetty jokaiseen kiraalikeskukseen. Ryhmien prioriteetti on osoitettu atomin atomin lukumäärän mukaan, joka on suoraan kytketty Quiral Centeriin. Jos atomia on kaksi yhtä suurta, ensimmäiseen kytkettyjen atomien atominumeroita lisätään atomilukujen lisäämiseksi.
- Suunta, johon kolme prioriteettiryhmää kuljetetaan, kun alhaisimmat prioriteettipisteet takaisin määritetään.
- Jos reitin suunta on kellosuunnassa, kokoonpano määritetään R -, Muuten kokoonpano on määritetty S.
Esimerkki
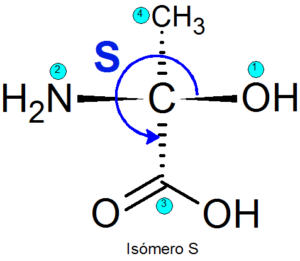
Esimerkkejä enantiomeereistä
D-glyseraldehydi ja L-glyeraldehydi
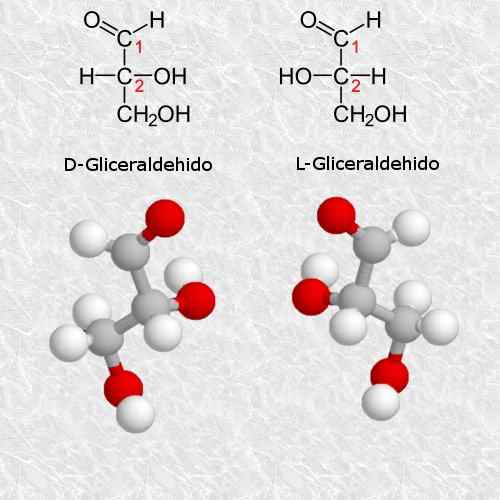
Glyseraldehydi on olemassa yksinkertaisin ja pienin quiral -hiilihydraatti, joka on erittäin tärkeä kemian ja biologian kannalta.
CAHN-Engold-prelog-järjestelmän sääntöjen mukaan d-isomeeri vastaa isomeeriä (R) ja L-isomeeri vastaa (s) (s).
D-Alanina ja L-Alanina
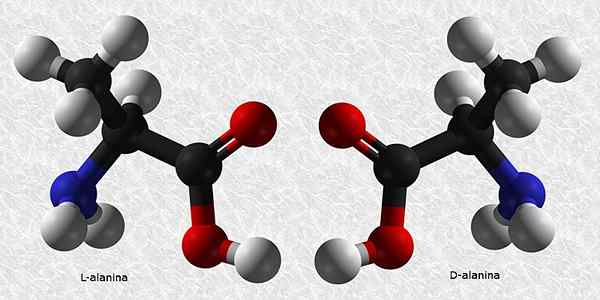
Alaniini on yksi välttämättömistä aminohapoista proteiinien rakentamiseksi. Kuten melkein kaikki aminohapot, siinä on kiraalinen hiili, joten siinä on kaksi enantiomeeriä:
Näistä kahdesta L-alanina on yleisin ja esiintyy kaikissa elävissä olennoissa, kun taas D-Alanina on läsnä vain joissain bakteerisoluissa.
D-tartarinen ja L-tartarihappo
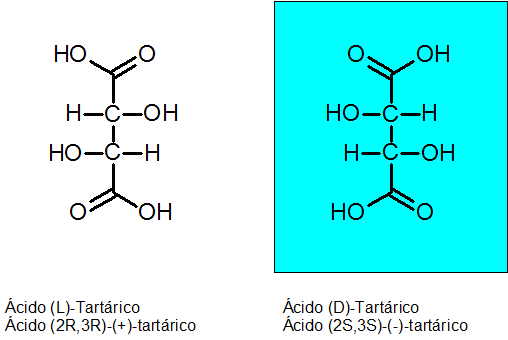
Louis Pasteur löysi kiraalisuuden vuonna 1848 tartarihapon ansiosta. Tällä yhdisteellä on 2 epäsymmetristä hiiliä ja se voi olla kahtena enantiomeerinä sekä kolmas isomeeri, jota kutsutaan MESO -yhdisteeksi.
Kahden kiraalisen hiilen absoluuttinen konfiguraatio ovat R: n enantiómero Levógiro ja S dekstrogian enantiomille.
2-butanoli
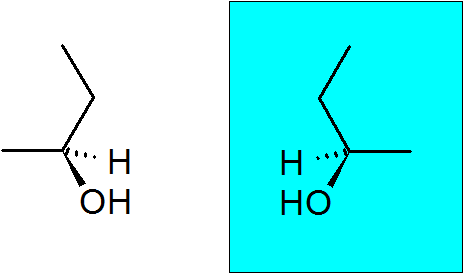
Tällä alkoholilla on myös quiral hiili, joka tekee tästä yhdisteestä kaksi enantiomeeriä.
Bromokloorotan
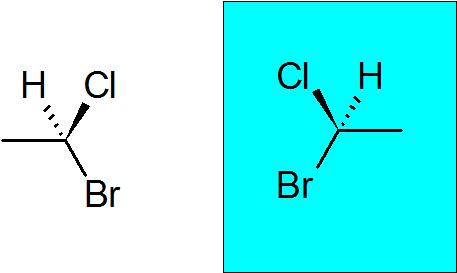
Se on hyvin yksinkertainen kiraalinen yhdiste, jossa on vain kaksi hiilyä. Quiral Carbon on liittynyt bromiin, klooriin, metyyliin ja vetyyn.
Viitteet
- Kiraalisuus (kemia). (18. maaliskuuta 2021), Wikipediasta.com
- Carey, f. -Lla. (2008). Orgaaninen kemia. Boston: McGraw-Hillin korkeakoulu.
- Smith, m., Maaliskuu, J., & Maaliskuu, J. (2001). Maaliskuun edistyksellinen orgaaninen kemia: reaktiot, mekanismit ja strupture. New York: Wiley.
- M.H. Hyun (2012). 8.13 Kromatografiset erottelut ja analyysi: Kiraaliset kruunueetteripohjaiset kiraaliset paikallaan olevat vaiheet. Toimittaja (t): Erick M. Carreira, Hisashi Yamamoto. Kiraalisuuden ymmärtäminen. Elsevier. Sivut 263-285. ISBN 9780080951683,
- Nguyen, L. -Lla., Hän, h., & Pham-Huy, c. (2006). Kiraaliset lääkkeet: yleiskatsaus. Biolääketieteen kansainvälinen lehti: IJBS, 2(2), 85-100.

