Gibbs -vapaat energiayksiköt, miten se lasketaan, ratkaistu harjoitus

- 3472
- 1090
- Juan Breitenberg V
Se Gibbs vapaa energia (Yleisesti kutsutaan g) on termodynaaminen potentiaali, joka on määritelty entalpia H: n erona, lukuun ottamatta lämpötilan T tuotetta, järjestelmän entropia:
G = h - t s
Gibbs -vapaa energia mitataan Joulesissa (kansainvälisen järjestelmän mukaan) Ergiosissa (yksikköjärjestelmässä), kaloreita tai elektronien volteja (Electro -volteille).
 Kuvio 1. Kaavio, joka osoittaa Gibbs -energian määritelmän ja sen suhteen muihin termodynaamisiin potentiaaleihin. Lähde: Ydinvoima.netto.
Kuvio 1. Kaavio, joka osoittaa Gibbs -energian määritelmän ja sen suhteen muihin termodynaamisiin potentiaaleihin. Lähde: Ydinvoima.netto. Prosesseissa, jotka esiintyvät vakiopaineessa ja lämpötilassa, Gibbs -vapaan energian variaatio on ΔG = ΔH - T ΔS. Tällaisissa prosesseissa (g) edustaa järjestelmässä käytettävissä olevaa energiaa, josta voi tulla työtä.
Esimerkiksi eksotermisissä kemiallisissa reaktioissa entalpia vähenee, kun entropia kasvaa. Gibbs -toiminnassa nämä kaksi tekijää torjuu, mutta vain kun Gibbs -energia vähenee, reaktio tapahtuu spontaanisti.
Joten jos G: n variaatio on negatiivinen, prosessi on spontaani. Kun Gibbs -funktio saavuttaa minimin, järjestelmä saavuttaa vakaan tasapainon. Lyhyesti sanottuna, prosessissa, jota varten paine ja lämpötila pysyvät vakiona, voimme vakuuttaa:
- Jos prosessi on spontaani, niin ΔG < 0
- Kun järjestelmä on tasapainossa: ΔG = 0
- Ei-spontaanissa prosessissa se kasvaa: ΔG> 0.
[TOC]
Kuinka se lasketaan?
Gibbs -vapaa energia (g) lasketaan alussa annetulla määritelmällä:
G = h - T⋅s
Entalpia H puolestaan on termodynaaminen potentiaali, joka on määritelty seuraavasti:
H = u + p v
- Askel askeleelta
Seuraavaksi tehdään askel -askelanalyysi, tuntemaan riippumattomat muuttujat, joista Gibbs -energia on funktio:
Ensimmäisestä termodynamiikan laista sisäinen energia liittyy järjestelmän entropiaan ja sen tilavuuteen V palautuvien prosessien suhteen differentiaalisuhteen kautta:
Se voi palvella sinua: etidiumbromidi: rakenne, ominaisuudet, käytöt, toksisuusdu = dq - dw = TDS - PDV
Tästä yhtälöstä seuraa, että sisäinen energia U on muuttujien s ja v: V:
U = u (s, v)
2- H: n määritelmästä ja differentiaalin ottamisesta saadaan:
dh = du + d (p v) = du + vdp + pdv
3- (1) saadun DU: n lausekkeen korvaaminen sinun on:
DH = TDS - PDV + VDP + PDV = TDS + VDP
Täältä pääteltään, että entalpia H riippuu entropiasta S ja Paine P: stä, eli:
H = h (s, p)
4- Nyt Gibbs-vapaan energiaeron kokonaismäärä lasketaan:
Dg = dh -tds -sdt = TDS + VDP -TDS -SDT
Missä DH on korvattu kohdassa (3) löydetyllä lausekkeella.
5- Lopuksi yksinkertaistamalla saat: Dg = VDP - SDT, On selvää, että vapaa energia G riippuu paineesta ja lämpötilasta T kuten:
G = g (p, t)
- Maxwellin termodynaamiset suhteet
Edellisen osan analyysistä seuraa, että järjestelmän sisäinen energia on entropian ja tilavuuden funktio:
U = u (s, v)
Sitten ero TAI olla:
du = ∂SU |V Ds + ∂VU |S DV = TDS - PDV
Tästä ekspressiosta osittaisjohdannaisissa voidaan päätellä So -called Maxwell -termodynaamiset suhteet. Osittaisia johdannaisia sovelletaan, kun funktio riippuu useammasta kuin yhdestä muuttujasta ja lasketaan helposti soveltamalla seuraavan osan lause.
Maxwellin ensimmäinen suhde
∂VT |S = -MonSP |V
Päästäksesi tähän suhteeseen, Clairaut -lause - Schwarz osittaisjohdannaisilla, joissa on seuraava:
"Toisen asteen sekoitettua johdannaisia vaihdettujen muuttujien kanssa ovat samat, mikäli johdettavat toiminnot ovat jatkuvia ja erilaistuvia".
Maxwellin toinen suhde
Alkaen siitä, mitä esitettiin edellisen osan 3 kohdasta:
Voi palvella sinua: liukoisuuteen vaikuttavat tekijätH = H (S, P) ja DH = TDS + VDP
Voidaan saada:
∂PT |S = ∂SV |P
Jatka samalla tavalla Gibbs -vapaan energian avulla G = g (p, t) ja Helmholtzin vapaalla energialla F = f (t, v) Maxwellin kaksi muuta termodynaamista suhdetta.
 Kuva 2. Josiah Gibbs (1839-1903) oli amerikkalainen fyysikko, kemisti ja matemaatikko, joka antoi suuren panoksen termodynamiikkaan. Lähde: Wikimedia Commons.
Kuva 2. Josiah Gibbs (1839-1903) oli amerikkalainen fyysikko, kemisti ja matemaatikko, joka antoi suuren panoksen termodynamiikkaan. Lähde: Wikimedia Commons. Maxwellin neljä termodynaamista suhdetta
1- liittyy sisäiseen energiaan U: ∂VT |S = -MonSP |V
2- Entalpia H: sta saatu h: ∂PT |S = ∂SV |P
3- liittyy Helmholtz F: n energiaan: ∂TP |V = ∂VS |T
4- Sidottu Gibbs G: n vapaaseen energiaan: ∂TV |P = -MonPS |T
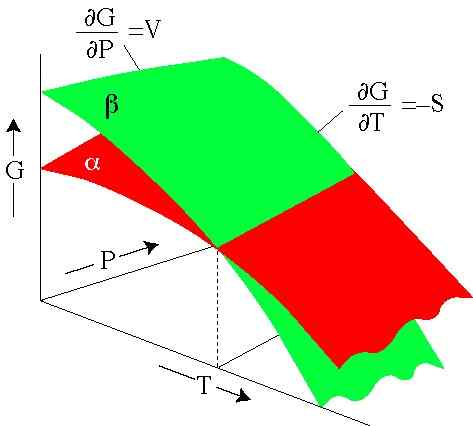 Kuva 2. Gibbsin energia riippuu painosta ja lämpötilasta. Jokainen pinta edustaa vaihetta. (SERC.Carleton.Edu)
Kuva 2. Gibbsin energia riippuu painosta ja lämpötilasta. Jokainen pinta edustaa vaihetta. (SERC.Carleton.Edu) Ratkaisut
Harjoitus 1
Laske Gibbs -vapaan energian variaatio kahdelle moolille ihanteellista kaasua 300 000 lämpötilassa isotermisen laajentumisen aikana, joka johtaa 20 litran alkuperäiseen tilavuusjärjestelmään 40 litran lopulliseen tilavuuteen.
Ratkaisu
Gibbs -vapaan energian määritelmän muistaminen on:
G = h - t s
Sitten F: n rajallinen variaatio on:
Δg = ΔH - t ΔS, Koska Δt = 0
Ihanteellisissa kaasuissa entalpia riippuu vain sen absoluuttisesta lämpötilasta, mutta koska se on isoterminen prosessi, sitten ΔH = 0 ja ΔG = - T ΔS.
Ihanteellisille kaasuille isotermisen prosessin entropian vaihtelu on:
ΔS = nr ln (v2/V1-A
Se sovellettiin tämän harjoituksen tapaukseen:
ΔS = 2 moolia x 8,314 j/(k mol) x ln (40L/20L) = 11,53 J/K
Sitten voimme saada muutoksen Helmholtzin energiassa:
ΔG = - 300 k x 11,53 j/k = -3457,70 J.
Harjoitus 2
Kun otetaan huomioon, että Gibbs -vapaa energia on lämpötilan ja paineen g = g (t, p) funktio; Määritä G: n vaihtelu prosessin aikana, jossa lämpötila ei muutu (isoterminen) ihanteellisen monooatoisen kaasun N -moolien kohdalla.
Voi palvella sinua: strontiumhydroksidi (sr (OH) ₂)Ratkaisu
Kuten edellä on osoitettu, Gibbsin energian muutos riippuu vain lämpötilan T ja tilavuuden V muutoksesta, joten sen äärettömä vaihtelu lasketaan:
Dg = -sdt + vdp
Mutta jos se on prosessi, jossa lämpötila on vakio, niin DF = + VDP, joten paineen äärellinen variaatio ΔP johtaa Gibbs -energian muutokseen:
Δg = + ∫ vdp = + ∫ (n r t) dp/p = + n r t ln (Δp)
Ihanteellisen kaasuyhtälön käyttäminen:
P v = n r t
Isotermisen prosessin aikana tapahtuu, että:
D (p v) = p dv + v dp = 0
Tuo on:
DP/P = - DV/V
Joten edellinen tulos voidaan kirjoittaa tilavuuden vaihtelusta riippuen ΔV-
Δg = + ∫ vdp = + ∫ (n r t) dp/p = - ∫ (n r t) dv/v = -n r t ln (Δv)
Harjoitus 3
Seuraavan kemiallisen reaktion huomioon ottaminen:
N20 (g) + (3/2) tai2 (g) ↔️No2 g) lämpötilassa t = 298 K
Löydä Gibbs -vapaan energian variaatio ja osoita saadun tuloksen kautta, onko se spontaani prosessi.
Ratkaisu
Vaiheiden alapuolella:
- Ensimmäinen askel: Reaktion entalpit
Δhr = 2*ΔH (ei2 (g)) - ΔH (n20 (g)) = 2*33,2-81,6 = -15,2 kj/mol
- Toinen vaihe: Reaktion entropian variaatio
ΔSr = 2*s (ei2 (g)) - s (n20 (g)) - (3/2) s (tai2 (g)) = 2*240,1 - 220,1 - 1,5*205,2 = -47,7 J/(mol*k).
- Kolmas vaihe: Gibbs -toiminnon variaatio
Tämä arvo määrittää tasapainon vähenevän energian ja lisääntyvän entropian välillä tietääkseen, onko reaktio lopulta spontaani vai ei.
Δgr = Δhr -t ΔSr = -15,2 -298*(-47,7) = -985,4 j/mol
Koska se on Gibbs -energian negatiivinen variaatio, se voidaan päätellä, että se on spontaani reaktio lämpötilassa 298 K = 25 ºC.
Viitteet
- Castaños e. Ilmaiset energiaharjoitukset. Toipunut: lidiaconlachimica.WordPress.com.
- Cengel, ja. 2012. Termodynamiikka. 7. painos. McGraw Hill.
- Librettexts. Gibbs vapaa energia. Palautettu: Chem.Librettexts.org
- Librettexts. Mitkä ovat ilmaista energiaa. Palautettu: Chem.Librettexts.org
- Wikipedia. Gibbs vapaa energia. Palautettu: on.Wikipedia.com
- Wikipedia. Gibbs vapaa energia. Haettu: vuonna.Wikipedia.com
- « Mohr -menetelmän perusteet, reaktiot, menettely, käyttö
- Kitejärjestelmien käsite ja karakterisointi, tyypit, esimerkit »

