Kolminkertainen sidos
- 4429
- 243
- Gustavo Runte DVM
Selitämme, mikä on kolminkertainen linkki, sen ominaisuudet ja annamme useita esimerkkejä
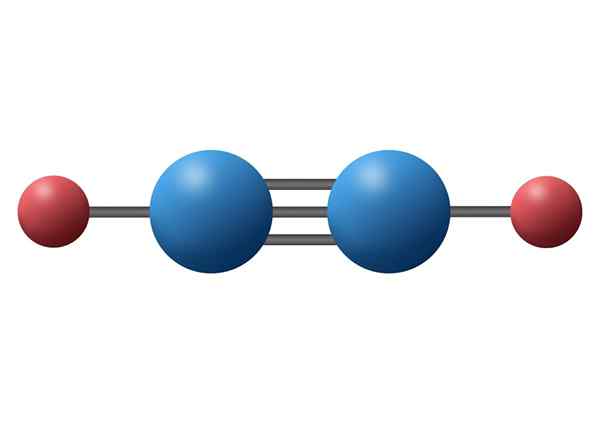 Asetyleenimolekyyli (C2H2) sen kolminkertaisella sidoksella kahden hiiliatomin välillä
Asetyleenimolekyyli (C2H2) sen kolminkertaisella sidoksella kahden hiiliatomin välillä Mikä on kolminkertainen kovalenttinen linkki?
Se kolminkertainen kovalenttiset sidokset Ne ovat kemiallisia linkkejä, joissa kahdella atomilla on kolme paria elektroneja. Toisin sanoen, ne ovat kovalenttisia sidoksia, jotka muodostavat yhteensä kuusi valenssielektronia, jotka pyörivät kahden atomin ympärillä.
On monia kemiallisia yhdisteitä, jotka sisältävät kolminkertaisia linkkejä. Esimerkiksi orgaaniset yhdisteet, kuten alkynit, sisältävät kolminkertaiset C-C-kovalenttiset sidokset. Nitriilejä on myös ominaista, että sillä on ryhmä, joka sisältää typeen kytketyn hiilen kolminkertaisen C-N-kovalenttisen sidoksen avulla. Muut epäorgaaniset yhdisteet, kuten ilmassa.
Kahden ytimen ympäri kääntyvä 6 elektronia antaa kolminkertaiset linkit monia erityisiä ominaisuuksia. Sekä niitä sisältävien molekyylien muoto että kemialliset reaktiot, joihin ne voivat osallistua.
Kolminkertainen kovalenttiset linkkiominaisuudet
Ne muodostuvat 6 elektronia
Nämä sidokset muodostuvat 6 elektronia ja muodostetaan, kun molemmat kahdesta atomista on kolme sen kadonneista elektronista muiden kanssa. Tästä syystä niitä kutsutaan kolminkertaiseksi linkkeiksi, koska niillä on kolminkertainen yksinkertaisen kovalenttisen sidoksen elektronien lukumäärä.
Heillä on Sigma -linkki (σ) ja kaksi Pi (π) -linkkiä
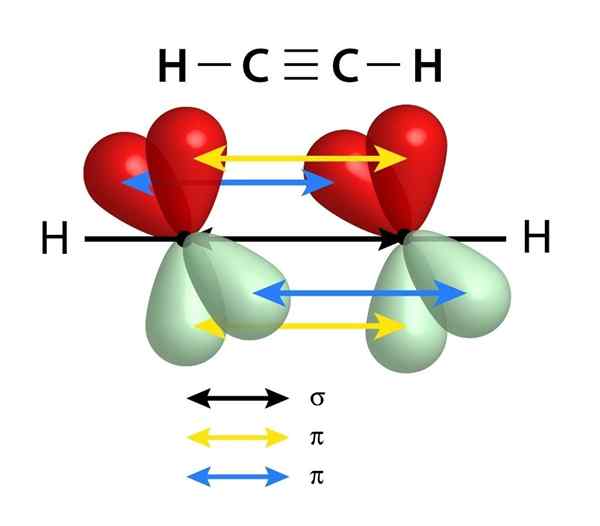 Linkkien kaavio, jotka muodostavat kolminkertaisen yhteyden kahden hiiliatomin välillä. Keskustan musta nuoli edustaa Sigma -linkkiä, kun taas keltainen ja sininen edustavat kutakin kahdesta PI -sidoksesta
Linkkien kaavio, jotka muodostavat kolminkertaisen yhteyden kahden hiiliatomin välillä. Keskustan musta nuoli edustaa Sigma -linkkiä, kun taas keltainen ja sininen edustavat kutakin kahdesta PI -sidoksesta Samoin kuin kaksoissidokset, kolminkertaiset linkit muodostuvat myös Sigma -linkillä, joka kulkee kahden linkitetyn atomin yhdistävän linjan keskuksen läpi. Toisin kuin kaksoislinkit, joilla on yksi, kolminkertaisilla linkeillä on kuitenkin kaksi PI -linkkiä Sigma -linkin lisäksi.
Voi palvella sinua: kuparikloridi (i) (cucl): rakenne, ominaisuudet, käyttötarkoituksetNe muodostavat melkein aina lineaarisia yhdisteitä
Kun kaksi hiiliatomia muodostavat kolminkertaisen linkin, jokaisella on edelleen mahdollisuus muodostaa ylimääräinen yksinkertainen linkki toiseen atomiin (koska hiili voi muodostaa yhteensä 4 sidosta).
Näissä tapauksissa sekä kaksi hiiliä että kaksi muuta atomia muodostavat suoran linjan. Tätä muotoa, jonka molekyyli hankkii.
Ne ovat vahvimmat kovalenttiset sidokset
Kun verrataan kahden atomin välisiä kolminkertaisia yhteyksiä näiden samojen atomien välisten kaksois- ja yksinkertaisten sidoksien välillä, havaitaan, että kolminkertaiset yhteydet ovat aina vahvempia kuin muut kovalenttiset sidostyypit. Tämä tarkoittaa, että on vaikeampaa rikkoa kolminkertainen linkki kuin kaksinkertainen tai yksinkertainen.
Tämä johtuu siitä, että lisäksi sigma -linkin (joka on läsnä myös sekä yksinkertaisissa että kaksoissidoksissa), ei tarvitse rikkoa (kuten kaksoislinkkeissä), mutta kaksi ylimääräistä PI -sidosta.
Ne ovat lyhyempiä kuin kaksoissidokset tai yksinkertaiset
Koska kolminkertaiset linkit hallitsevat saman tosiasian, että se on vahvempi linkkejä.
Ne edustavat kahta tyydyttymättömyyttä
Jokaisella hiilellä, jolla on kolminkertainen sidos, on vain ylimääräinen yhteys toiseen atomiin. Tämä tarkoittaa, että tällainen hiili yhdistetään vain kahteen atomiin neljän sijasta, joten sillä on vähemmän vetyä kuin se voisi hallussaan, jos se muodosti vain yksinkertaisia sidoksia.
Voi palvella sinua: Heptano (C7H16): rakenne, ominaisuudet ja käytötTätä kutsutaan tyydyttymättömyydeksi, ja yhdisteillä, joissa on kolminkertainen linkki.
Ne ovat jäykkiä linkkejä
Kuten kaksoissidokset, kolminkertaiset linkit ovat jäykkiä ja vaikea taivuttaa tai kiertää. Tämä johtuu sekä suuremmasta linkkivoimasta että pienimmällä pituudella.
He voivat toimia emäksinä
Jotkut yhdisteet, joissa on kolminkertaiset linkit+, Siksi toimivat emäksinä.
He voivat vedata heitä antamaan kaksinkertaiset tai yksinkertaiset linkit
Kolminkertaisen linkin tyydyttyminen voidaan poistaa rikkomalla PI -sidokset ja lisäämällä vetyjä kahteen hiilihiiliin. Tätä kutsutaan hydraukseksi. Jos lisätään vain vetymolekyyli kolminkertaiseen sidokseen, siitä tulee kaksoissidos. Jos lisätään kaksi vetymolekyyliä, siitä tulee yksinkertainen sidos.
Esimerkkejä kolminkertaisista kovalenttisista linkeistä
Typpimolekyyli (n2-A
Typpimolekyyli sisältää kolminkertaisen kovalenttisen sidoksen kahden typpiatomin välillä. Jokaisella atomilla on kolme valenssielektronia katosi toisen kanssa, ja jokaisesta uudesta parista elektronista tulee sigma -sidos tai toinen kahdesta PI -sidoksesta, jotka molekyylillä on.
 Typpimolekyyli
Typpimolekyyli Tässä tapauksessa sekä kaksi typpiatomia että vahingoittumattomia elektronia paria, jotka kukin niistä sijaitsevat suoraa linjaa pitkin.
Oikea (kaavan C alkyne3H4-A
Oikea on toinen yksinkertaisin alky, joka on olemassa. Tämä yhdiste koostuu kolmen hiiliketjusta, joista kaksi on kytketty kolminkertaisen kovalenttisen linkin kautta.
Voi palvella sinua: tyydyttymättömät hiilivedyt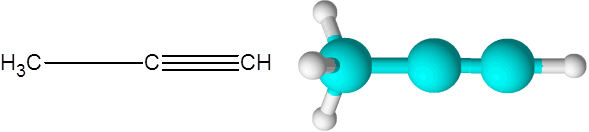 Propino -molekyyli
Propino -molekyyli Täällä voit myös nähdä, että kolme hiilyä ja viimeinen vetyatomi (oikealla) muodostavat suoran linjan. Mallissa voidaan myös nähdä, että yksinkertainen C-C-linkki on pidempi kuin kolminkertainen C-C-linkki.
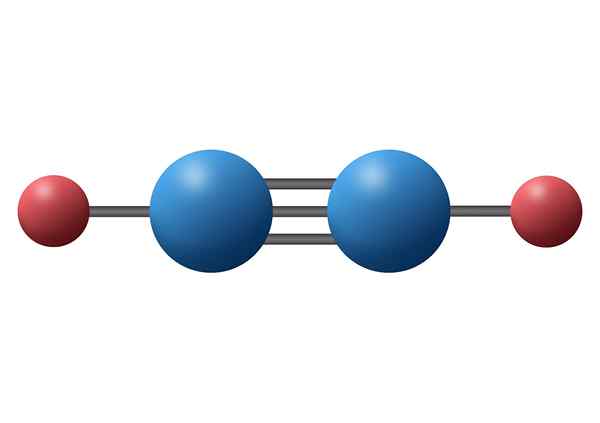
Hiilimonoksidi (CO)
Hiilimonoksidi on myrkyllinen epäorgaaninen kaasu, jolla on negatiivinen hiiliatomi ja positiivinen happi, joka on kytketty kolminkertaisen kovalenttisen sidoksen avulla. Tässä tapauksessa se on polaarinen sidos johtuen hiilen ja hapen välisen elektronegatiteetin eroista.
 Hiilimonoksidimolekyyli
Hiilimonoksidimolekyyli

