Enolaasirakenne, toimintamekanismi, toiminnot
- 1596
- 451
- Dr. Travis Reichert
Se Enolaasi D-2-fosfoglyseraation (2PGA) muuntamisen suorittaminen fosfoenolypyruvaatissa (PEP) glykolyysissä ja käänteisreaktiossa glukoneogeneesissä on d-2-fosfoglyseraation (2PGA) muuntaminen, kaksi metabolista reittiä, jotka ovat osa solun energian aineenvaihduntaa.
Päätös katalysoida tätä reaktiota yhteen tai toiseen suuntaan riippuu pääsystä, joka solulla glukoosilla on. Toisin sanoen aineenvaihdunnan mukauttamisen tarpeista hajoamiseen tai synteesiin energian saamiseksi. Välttämätöntä sen elintärkeiden prosessien toteuttamisessa.
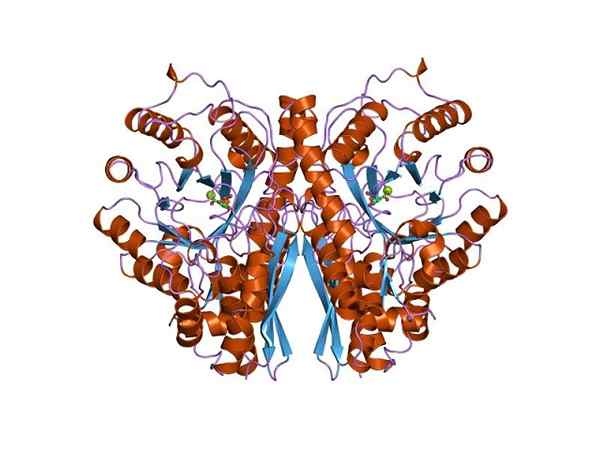
 Enolasan kolmen dimensioinen rakenne. Kirjoittanut Jawahar Swaminathan ja MSD: n henkilökunta Euroopan bioinformatiikan instituutissa [julkinen alue (https: // creativecommons.Org/lisenssit/by-SA/4.0)], Wikimedia Commons.
Enolasan kolmen dimensioinen rakenne. Kirjoittanut Jawahar Swaminathan ja MSD: n henkilökunta Euroopan bioinformatiikan instituutissa [julkinen alue (https: // creativecommons.Org/lisenssit/by-SA/4.0)], Wikimedia Commons. Koska molemmat aineenvaihduntareitit kuuluvat elävien olentojen keskusmenetelmän keskustaan, ei ole outoa, että tämän proteiinin aminohapposekvenssi säilyy arkkien, bakteerien ja eukaryootien kanssa. Ja siksi se esiintyy samanlaisia katalyyttisiä ominaisuuksia.
Enolaasin sijainti solussa on rajoitettu sytosoliin, osastoon, jossa sekä glykolyysi (kutsutaan myös glykolyysiin) että glukoneogeneesiin useimmissa organismeissa.
Sitä on kuitenkin havaittu myös muissa soluosastoissa, kuten monien syöpäsolujen ja solujen plasmamembraani. Siellä se näyttää olevan mukana solujen leviämisprosessien helpottamisessa, täysin erilainen toiminto kuin klassinen toiminto.
Entsyymit, jotka kykenevät suorittamaan useamman kuin yhden toiminnon, kuten enolaasi tekee, tunnetaan kuutamoina entsyymejä.
[TOC]
Rakenne
Linuksen kvaternäärinen rakenne tai ei sen ligandissa on määritetty suuressa määrässä prokaryoottisia ja eukaryootteja.
Jokainen monomeeri esittelee kaksi domeenia: pieni aminoterminaalinen domeeni ja suurempi karboksyyliterminaalinen domeeni. N-terminaalinen domeeni koostuu kolmesta a- ja neljästä P-levystä. Vaikka C-terminaali koostuu kahdeksasta P-arkista, jotka vuorottelevat niiden välillä muodostaen β-tynnyrin, jota ympäröivät kahdeksan a-potkuria.
Lisäksi jokaisesta monomeeristä löytyy kahta ammattiliittopaikan kaksiarvoisia kationeja, joita on kutsuttu "konformaatiokohdeksi" ja "katalyyttiseksi kohteeksi". Ensimmäinen ei ole kovin valikoiva ja voi liittyä monenlaisiin kaksiarvoisiin kationeihin substraatin puuttuessa.
Voi palvella sinua: Sfingolipidit: Mitkä ovat ominaisuudet, toiminnot, synteesiVaikka toinen sitoutuu ioneihin substraatin jälkeen, on liittynyt entsyymiin. Ionien liitto molemmille kohteille on elintärkeää reaktion jatkamiseksi.
Lopuksi on tärkeää mainita, että homodimeereissä monomeerit yhdistetään ylläpitämällä rinnakkaista suuntausta. Siksi aktiivinen paikka on rajoitettu mainitun unionin muodostamaan keskusalueeseen.
Kuitenkin vain yksi kahdesta monomeeristä osallistuu katalyysiin. Tämä selittää, että monomeerien kyky suorittaa reaktio kokeellisissa olosuhteissa.
Toimintamekanismi
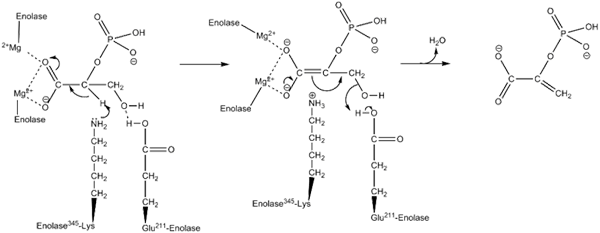 Entsyymi -inolaasi käyttää toimintamekanismia. KTHOMPSON08 INNIISESTI WIKIPEDIA.Org/lisenssit/by-SA/4.0)], Wikimedia Commons.
Entsyymi -inolaasi käyttää toimintamekanismia. KTHOMPSON08 INNIISESTI WIKIPEDIA.Org/lisenssit/by-SA/4.0)], Wikimedia Commons. Rakennetutkimukset, samoin kuin ne, jotka ovat sallineet Enolasan kineettisten ja fysikaalis -kemiallisten ominaisuuksien määrittämisen, ovat antaneet meille mahdollisuuden ymmärtää niiden toimintamekanismi.
Tapa, jolla entsyymi suorittaa reaktion katalyysin, on melko mielenkiintoinen. Yksi substraatti on kuitenkin ehdotettu järjestäytynyt peräkkäinen mekanismi.
Tämä alkaa Mg2+: n ionin liitoksella yhden monomeerin konformaatiokohtaan. Jatkuva substraatin liiton kanssa aktiiviseen kohtaan, jota seuraa toisen ionin liitos katalyyttiseen kohtaan ja päättyy tuotteen nopeaan vapautumiseen, kun reaktio on suoritettu. Tässä vaiheessa MG2+ pysyy kytkettynä konformaatiokohtaan.
Samoin kuin reaktion toteutumisen suosiminen keskimääräinen entsyymi ensinnäkin Carbanion -välittäjän muodostuminen, joka eliminoi 2PGA: n hiili 2. Tämä tekee niin emäksisen aminohappotähteen vaikutuksen ansiosta.
Peräkkäin hiili 3 hydroksyylipoisto tapahtuu happaman jäännöksen vaikutuksella entsyymistä. Tässä vaiheessa molempien hiilen liitto suoritetaan kaksoissidoksen muodostamalla PEP: tä. Tällä tavoin reaktio huipentuu.
Se voi palvella sinua: Monera Kingdom: Ominaisuudet, luokittelu ja esimerkitFunktiot
Monet tähän mennessä tutkituista entsyymeistä kykenevät suorittamaan monenlaisia toimintoja, jotka eivät liity niiden "klassiseen toimintaan" eri soluosastoissa. Näitä entsyymejä on kutsuttu "Moonlighting" -entsyymeiksi.
Tässä mielessä enolaasia voidaan pitää entsyyminä kuunvalaistuksena, koska niiden klassista toimintoa vastustavat lukuisat toiminnot on tähän mennessä annettu sekä bakteereissa että eukaryotteissa.
Jotkut näistä toiminnoista ovat seuraavia:
- Osallistu solumuodon ja vesikulaarisen liikenteen ylläpitämiseen vuorovaikutuksessa sytoskeletonproteiinien kanssa.
- Nisäkässolujen ytimessä toimii transkriptiotekijänä, joka säätelee solujen lisääntymiseen liittyvien geenien ilmentymistä. Yhteistyössä RNM: n stabiilisuuden ylläpitämisessä bakteerien hajoamisessa.
- Patogeeneissä, kuten Streptococcus pneumoniae ja Trypanosoma Cruzi, Vaikuttaa siltä, että se toimii tärkeänä virulenssitekijänä.
- On myös havaittu, että vuonna Streptococcus pyogenes, Enolaasi erittyy solunulkoiseen väliaineeseen, joka helpottaa kudoksen hajoamista ja isäntäjärjestelmän kiertämistä.
- Kasvainsolujen pinnalla se ekspressoituu parantamalla etäpesäkettä.
Enolaasi ja sen suhde solujen leviämismekanismeihin
Lukuisat patogeenit, samoin kuin kasvainsolut, ekspressoivat niiden kalvossa tai eritettäessä solunulkoisia väliaineproteaaseita, jotka kykenevät hajottamaan proteiiniproteiineja.
Tämä kapasiteetti antaa näiden solujen murtautua kudoksiin ja levittää nopeasti koko isäntä -organismissa. Siten suosimalla immuunijärjestelmän kiertämistä ja siksi tartunnan luomista.
Jopa silloin, kun Enolasasta puuttuu proteaasi -aktiivisuus, osallistuu prosessiin, jolla levittää monia taudinaiheuttajia isännässään ja kasvainsoluissa maalistantaasien aikana.
Tämä saavuttaa sen, koska se ilmenee näiden solujen pinnalla, joka toimii plasminogeenireseptorina. Jälkimmäinen on seriiniprototaasin zimogeeni.
Siksi pinnalla ekspressoitu enolaasi on strategia, jonka nämä solut ovat hankkineet infektion luomiseksi ja leviämiseksi onnistuneesti.
Se voi palvella sinua: Sympatrinen spesifikaatio: Konsepti, ominaisuudet ja esimerkitTämä strategia koostuu kahdesta prosessista:
- Isännän immuunijärjestelmän kiertäminen. Koska kun nämä isäntäproteiinin solut ovat päällystetty, immuunijärjestelmän solut huomioivat ne, jotka tunnistavat taudinaiheisiin liittyvät ei -omat patogeenit.
- Plasminogeenin toiminnan jälkeinen leviäminen plasminaatissa. Jonka osallistuminen solunulkoisten matriisiproteiinien hajoamiseen, sitten helpottaa nopeaa ja tehokasta leviämistä.
Viitteet
- Avilan L, Gualdron-Lopez M, Quiñones W, González-González L, Hannaert V, Michels Paa, Concepción JL. ENOLASE: Avainpelaaja aineenvaihdunnassa ja todennäköinen trypanosomatidien loisten virulenssitekijä, joka käyttää sen käyttöä terapeuttisena tavoitteena. Entsyymitutkimus. 2011 Vol. Artikkeli ID932549, 14 sivua.
- Bhowmick I, Kumar N, Sharma S, Coppens I, Jarori GK, Plasmodium falciparum enosoase: vaihe-spesifinen ekspressio ja solujen lokalisointi. Malarialehti. 2009; 8 (1). 179 artikla.
- Päivä I, Peshavaria M, Quinn GB, differentiaalinen molekyylikello enoase -isoproteiinin evoluutiossa. Journal of Molecular Evolution. 1993; 36 (6): 599-601.
- Torre-Scuder E, Manzano-Román R, Pérez-Sánchez R, Siles-Lucas M, Oleaga A. Plasminogeenia sitovan pinta -assosioituneen enolaasin kloonaus ja karakterisointi Schistosoma bovis. Eläinlääkäri. 2010; 173: 73-84.
- Dinovo EC, Boyer PD. Enolaasireaktiomekanismin isotooppiset koettimet. Alkuperäiset ja tasa -arvoiset isotooppien valuuttakurssit: primaariset ja secandary isotooppivaikutukset. J Biol Chem. 1971; 246 (14): 4586-4593.
- Kaberdin VR, Lin-Chao S, uusien roolien purkaminen E: n pienille komponenteille. Coli RNA -hajoaminen. RNA -biologia. 2009; 6 (4): 402-405.
- Keller A, Peltzer J, Carpentier G. Enolasin vuorovaikutus. Biochimica et Biophysica Acta. 2007; 1770 (6): 919-926.
- Lung J, Liu KJ, Chang JY, Leu SJ, Shih NY. MBP-1 on tehokkaasti koodattu ENRI1-geenin vaihtoehtoisella transkriptilla, jota säätelee proteasomiriippuvainen proteiininsiirto. FEBS Journal. 2010; 277 (20): 4308-4321.
- Pancholi V. Monitoiminen a-enolaasi: sen rooli sairauksissa. Solu- ja molekyylieläintieteet. 2001; 58 (7): 902-920.
- Poyner RR, Cleland WW, Reed GH. Metallin INS: n rooli katalyysissä enolaasin avulla. Tilattu kineettinen mekanismi yhdelle substraattientsyymille. Biokemia. 2001; 40: 9008-8017.
- Segovia-Gamboa NC, Chávez-Munguía B, Medina-Flores A, Entamoeba Invadens, Encystation -prosessi ja enolaasi. Kokeellinen parasitologia. 2010; 125 (2): 63-69.
- Tanaka M, Sugisaki K, Nakashima K, kääntäminen käännettävien mRNA: ien tasoilla enoase -isotsyymeille Chickin luurankojen lihaksen kehityksen aikana. Biokemiallinen ja biofysikaalinen tutkimusviestintä. 1985; 133 (3): 868-872.

