Reaktion entalpia, lämpökemia, harjoitukset

- 4806
- 101
- Arthur Terry II
Se reaktion entalpia Se on termodynaaminen funktio, jonka avulla voit laskea kemialliseen reaktioon saadun tai toimitetun lämmön, mikäli tämä reaktio on tapahtunut vakiopaineessa. Se määritellään sisäiseksi energiaksi tai plus paineen P tuote kemialliseen reaktioon osallistuvien aineiden tilavuudella V, seuraavasti: H = U + P ∙ V
Siksi entalpialla on energiaa, ja kansainvälisessä toimenpiteessä se mitataan Joulesissa. Entalpian suhteen ymmärtämiseksi kemiallisessa reaktiossa vaihdetun lämmön kanssa on tarpeen muistaa ensimmäinen termodynamiikan laki, joka vahvistaa seuraavat: q = ΔU + w
 Kuvio 1. Kaasun palamisessa entalpia vähenee. Lähde: Pixabay
Kuvio 1. Kaasun palamisessa entalpia vähenee. Lähde: Pixabay Ensimmäisessä laissa todetaan, että termodynaamisessa prosessissa vaihdettu lämpö on yhtä suuri kuin prosessiin osallistuvien aineiden sisäisen energian variaatio sekä näiden aineiden suorittama työ prosessissa.
Jokaisessa prosessissa W -työ lasketaan seuraavalla suhteella:
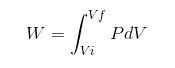
Edellisessä lausekkeessa VI on alkutilavuus, VF lopullinen tilavuus ja p paine. Jos prosessi suoritetaan jatkuvan paineessa P, tuloksena oleva työ on:
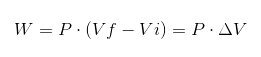
Missä ΔV on tilavuuden vaihtelu.
[TOC]
Määritelmä
Kemialliset reaktiot ovat termodynaamisia prosesseja, jotka yleensä tapahtuvat vakiopaineessa ja hyvin usein ilmakehän paineessa. Tämän tyyppisiä termodynaamisia prosesseja kutsutaan "isobariksi", koska se tapahtuu vakiopaineessa.
Tässä tapauksessa termodynamiikan ensimmäinen laki voidaan kirjoittaa näin:
Qp = Δu + p ∙ ΔV
Missä QP osoittaa, että lämpö on vaihdettu vakiopaineessa. Jos entalpian määritelmä h = u + p ∙ v saatu, niin:
Qp = ΔH
Sieltä sinun on muutettava positiivinen entalpia osoittaa reaktion, joka on ottanut lämpöä ympäristöstä. Tämä on endoterminen reaktio.
Voi palvella sinua: Ton: Muutokset, vastaavuudet ja harjoitukset ratkaistuPäinvastoin, jos entalpian muutos on negatiivinen, se on niin eksoterminen reaktio.
Itse asiassa sana entalpia tulee kreikkalaisesta sanasta Entalpien, jonka merkitys on "lämpö".
Usein entalpiaa kutsutaan myös lämpöä. Mutta on oltava selvää, että se ei ole sama kuin lämpö, mutta entalpia muuttaa lämmönvaihtoa termodynaamisen prosessin aikana.
Lämmönsuhde
Toisin kuin lämpö, entalpia on valtion funktio. Kun entalpian muutos lasketaan, kahden toiminnon ero, jotka riippuvat yksinomaan järjestelmän tilasta, kuten sisäinen energia ja tilavuus, lasketaan.
ΔH = ΔU + p ∙ ΔV
Kuten reaktiossa paine pysyy vakiona, niin reaktion entalpia on tilafunktio, joka riippuu vain sisäisestä energiasta ja tilavuudesta.
Kemiallisessa reaktiossa reagenssien entalpia voidaan määritellä kunkin niistä summana; ja tuotteiden summa kaikkien tuotteiden entalpian summana.
Entalpian muutos reaktiossa on ero tuotteiden eroon paitsi reagenssit:
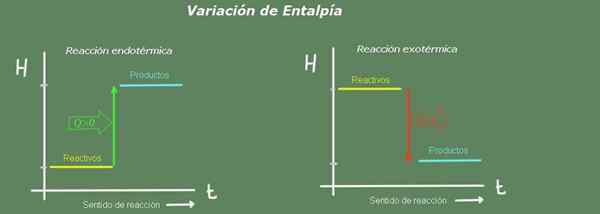 Kuva 2. Entalpiakaavio. Lähde: Itse tehty.
Kuva 2. Entalpiakaavio. Lähde: Itse tehty. Endotermisessä reaktiossa tuotteiden entalpia on suurempi kuin reagenssien reaktio; eli reaktio vie lämpöä ympäristöstä. Päinvastoin, exotermisessä reaktiossa reagenssien entalpia on suurempi kuin tuotteiden reaktio, koska reaktio antaa lämpöä ympäristölle.
Tavanomainen entalpia
Koska entalpian muutos kemiallisessa reaktiossa voi riippua paineesta ja lämpötilasta, on tapana määritellä standardireaktio -olosuhteet:
Se voi palvella sinua: Kalibrointikäyrä: Mihin se on, miten se tehdään, esimerkkejäVakioreaktion lämpötila: 25 ° C.
Tavallinen reaktiopaine: 1 atm = 1 bar.
Tavallinen entalpia merkitään seuraavasti: h °
Termokemia
Lämperakemiallisessa yhtälössä ei vain ainesreagensseja ja tuotteita, entalpian variaatio on myös. Entalpia ymmärretään reaktiona hänen muutokseensa, jolla oli paikka.
Esimerkiksi katsotaan seuraavat reaktiot:
2 H2 (kaasu) + O2 (kaasu) → 2 H2O (neste); ΔH ° = -571,6 kJ (eksoterminen).
H2 (kaasu) + (½) O2 (kaasu) → H2O (neste); ΔH ° = -285,8 kJ (eksoterminen).
2 H2O (neste) → 2 H2 (kaasu) + O2 (kaasu); ΔH ° = +571,6 kJ (endoterminen).
Entalpia on laaja termodynaaminen määrä
Jos kemiallisen yhtälön ehdot kerrotaan tai jaetaan tietyllä tekijällä, niin entalpia kerrotaan tai jaetaan sillä.
Jos reaktio sijoitetaan, myös reaktion entalpian merkki sijoitetaan.
Ratkaisut
-Harjoitus 1
C2H2 -asetyleenikaasu saadaan CAC2 -kalsiumkarbidireaktiosta, joka tulee rakeistetulla tavalla veden kanssa ympäristössä ja ympäristöpaineessa.
Tietoina reagenssin muodostumisessa on entalpia:
ΔH ° (CAC2) = -59,0 kJ/mol
ΔH ° (H20) = -285,8 kJ/mol
Ja tuotteiden muodostumisen entalpia:
ΔH ° (C2H2) = +227,0 kJ/mol
ΔH ° (Ca (OH) 2) = -986,0 kJ/mol
Etsi reaktion vakio entropia.
Ratkaisu
Ensimmäinen asia on nostaa tasapainoinen kemiallinen yhtälö:
CAC2 (S) + 2H20 (L) → CA (OH) 2 (S) + C2H2 (G)
Ja nyt reagenssien, tuotteiden ja reaktion entalpit:
- Reagenssit: -59,0 kJ/mol -2 ∙ 285,8 kJ/mol = -630,6 kj/mol
- Tuotteet: -986,0 kJ/mol + 227,0 kJ/mol = -759 kJ/mol
Se voi palvella sinua: Mitkä ovat koplanaresvektorit? (Ratkaistujen harjoitusten kanssa)- Reaktio: ΔH ° = -759 kJ/mol -( -630 kJ/mol) = -129 kJ/mol
Se on eksoterminen reaktio.
-Harjoitus 2
Kun 1 litran asetyleeniä palaa vakioolosuhteissa, kuinka paljon lämpöä se irtoaa?
Ratkaisu
Asetyleenin palamisreaktio tasapainossa on tällainen:
C2H2 (g) + (5/2) O2 (g) → 2 CO2 (g) + H20 (l)
Tarvitsemme entalpikoita tuotekainasta:
ΔH ° (CO2) = -393,5 kJ/mol
ΔH ° (H2O (l)) = -285,8 kJ/mol
Entalpian laskenta
Näiden tietojen avulla voimme laskea tuotteiden entalpian:
ΔH ° (tuotteet) = 2*(-393,5 kJ/mol) + (-285,8 kJ/mol) = -1072,8 kJ/mol
Ja reagenssin muodostumisen entalpia:
ΔH ° (C2H2) = 227,0 kJ/mol
ΔH ° (O2) = 0,0 kJ/mol
Reagenssien entalpia on:
227,0 kJ/mol + (5/2)* 0,0 = 227,0 kJ/mol
Molaarireaktion entalpia on sitten: ΔH ° (tuotteet) - ΔH ° (reagenssit) = -1072,8KJ/mol - 227,0 kJ/mol = -1299,8 kJ/mol
Palamisen entalpia
Nyt meidän on tiedettävä, kuinka monta asetyleenimolia on litra asetyleeniä vakioolosuhteissa. Tätä varten käytämme ihanteellisen kaasun tilayhtälöä, josta puhdistamme moolien lukumäärän.
Moolien lukumäärä n = p*v/(r*t)
P = 1 atm = 1,013 x 10⁵ PA
V = 1 L = 1,0 x 10^-3 m³
R = 8,31 J/(mol*k)
T = 25 ° C = 298,15 K
N = 0,041 mol
1 litran asetyleenin palamisen entalpia on 0,041 mol * (-129,8 kJ/mol) = -53,13 kJ
Negatiivinen merkki osoittaa, että se on eksoterminen reaktio, joka antaa 53,13 kJ = 12,69 kcal.
Viitteet
- Castaños e. Entalpia kemiallisissa reaktioissa. Toipunut: lidiaconlachimica.WordPress.com
- Termokemia. Reaktion entalpia. Haettu: Resurssit.koulutus.On
- Termokemia. Määritelmä vakioreaktion entalpia. Palautettu: quimitube.com
- Wikipedia. Vakioreaktion entalpia. Toipunut: Wikipedia.com
- Wikipedia. Koulutus-. Toipunut: Wikipedia.com
- « Suhteelliset virhekaavut, miten se lasketaan, harjoitukset
- Mikä on tehtävän ponnistus ja miten se saadaan? »

