Nestemäinen tasapaino

- 3561
- 755
- Dr. Travis Reichert
Mikä on nestemäistä höyryn tasapainoa?
Hän nestemäinen tasapaino Se on dynaaminen tila, joka muodostaa nesteen, olipa se puhdasta ainetta tai seosta, höyryn kanssa, joka ympäröi ja on vuorovaikutuksessa sen kanssa. Kontti on suljettava, muuten ilmavirrat aiheuttaisivat nesteen haihtumaan hitaasti.
Kun järjestelmä on suljettu, höyryfaasimolekyylien aiheuttama paine nousee ajan myötä. Tulee kohta, jossa paine pysähtyy; Tämä on nesteen höyrynpaine, joka on aineen fysikaalinen ominaisuus, joka on riippumaton säiliön koosta tai nesteen tilavuudesta.
 Kun kaasujuoma on paljastamaton, sen nestemäinen höyryn tasapaino on häiriintynyt, mikä aiheuttaa pullon ulkopuolella ja sisällä olevien paineiden epätasapainoa, ja sen mukana kupli. Lähde: OpenStax, CC 4: llä.0, Wikimedia Commons
Kun kaasujuoma on paljastamaton, sen nestemäinen höyryn tasapaino on häiriintynyt, mikä aiheuttaa pullon ulkopuolella ja sisällä olevien paineiden epätasapainoa, ja sen mukana kupli. Lähde: OpenStax, CC 4: llä.0, Wikimedia Commons Jokaisessa nestemäisessä, puhtaassa tai sekoitettuna on siihen liittyvä höyrypaine, joka riippuu sen komponenttien volatiliteetista; Ja siksi molekyylien välisistä voimista, jotka pitävät ne yhdessä nesteen sisällä ja niiden pinnalla.
Tätä painetta voidaan kuvata olettamalla ratkaisujen ihanteet tai seoksen komponenttien sekoittuvuus. Tätä varten binaarikaavioiden käyttö on erittäin hyödyllistä, jossa on mahdollista miettiä erotusprosessin elinkelpoisuutta.
Nestemäisen höyryn tasapaino on välttämätön kemian tekniikan prosessien, kuten fraktiottislauksen ja vesihöyryn kanssa tehdyn, äärettömyyden kohdalla, jonka kautta saadaan tislattua tislattua haihtuvimpiin komponentteihin. Näin on etanolia 95.4% vedessä, joka on markkinoiden saatavilla ja taloudellisin alkoholiprosentti.
Puhtaat aineet
Puhtaan aineen molekyylit eivät ole vielä, vaan siirtyvät paikasta toiseen luontaisen kineettisen energian ansiosta. Tämä energia voi joskus olla riittävän suuri voittamaan molekyylien väliset voimat, jotka "vetävät" molekyylin tietyltä nesteen rintakehään. Sitten molekyyli pakenee nesteen pinnalta höyryfaasiin.
Höyryfaasissa molekyylit törmäävät astian sisäseiniin, voittaen tai menettävät nopeuden, kunnes ne yhdistyvät nesteen pinnan kanssa, missä ne ovat kerran integroimaan nestefaasin molekyylien ryhmittymistä.
Voi palvella sinua: koboltti: rakenne, ominaisuudet, sovelluksetSiten aika kuluu, kunnes tietyssä lämpötilassa (sanoen 25 ° C), pinnan poistuvien molekyylien lukumäärä on yhtä suuri kuin höyrystä tulevat. Siksi sanotaan.
Höyrynpaine kokea säiliön sisäseinät ja nesteen pinta on yhtä suuri kuin P-Llaº, joka on vakio ja toistettavissa; Riippumatta siitä, kuinka suuri tai pieni säiliö ei ole nesteen tilavuus harkittavaksi.
Seokset
Nestemäisissä seoksissa on myös komponentti, joka kohdistaa paine. Höyrypaineesi, kuten voidaan odottaa, koostuu seoksen kunkin komponentin osuuksista kahdesta aineesta A ja B. Nämä seokset voivat olla sekoittavia, osittain sekoittuvia.
Sekoittava
A- ja B: n välisessä sekoittavassa seoksessa molemmat aineet muodostavat yhden vaiheen, joka ensi silmäyksellä näyttää puhtaalta aineelta. Siten Daltonin lain mukaan seoksen tai liuoksen paine on yhtä suuri kuin:
Paurinko = P-Lla + PB - +··· PYllyttää
P -oleminenYllyttää mikä tahansa muu komponentti, joka on myös seoksessa. Huomaa, että p-Lla≠ p-Llaº, toisin sanoen seoksen aineiden paineet eivät ole samat kuin niiden korkean puhtauden tilojen paineet.
Olettaen, että ratkaisu on ihanteellinen, vuorovaikutusten A-A, B-B ja A-B: n erot ovat ilmeisiä. Tätä voidaan soveltaa esimerkiksi etanolin ja metanolin seokseen.
Siksi seoksen komponenttien höyrypaineet riippuvat niiden suhteellisista määristä nestefaasissa, ilmaistuna molaarisina fraktioina xYllyttää. Ja tässä Raaultin laki puuttuu asiaan, jolla pyritään yhdistämään paineen p-Lla Ja p-Llaº:
P-Lla = X-Lla P-Llaº
On nyt kokonaispaine yhtä suuri kuin:
Paurinko = X-Lla P-Llaº + xB - PB -º +···
Toisaalta höyryvaiheessa on omat koostumuksensa, jotka ilmaistaan yi molaarisina fraktioina:
Yi = pYllyttää / Paurinko
= XYllyttää PYllyttääº / Paurinko
Binaarikaavio
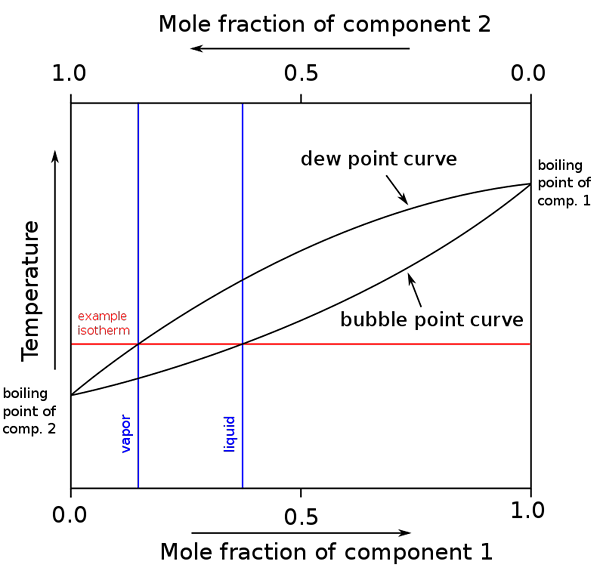 Kaavio kiehumispisteistä ja molaarisista koostumuksista binaariseokselle. Lähde: binary_boiling_point_diagram.PNG: H Padleckasderivatiivityö: Michbich, CC BY-Sa 2.5, Wikimedia Commons
Kaavio kiehumispisteistä ja molaarisista koostumuksista binaariseokselle. Lähde: binary_boiling_point_diagram.PNG: H Padleckasderivatiivityö: Michbich, CC BY-Sa 2.5, Wikimedia Commons Kun binaariseoksen komponenttien molaarifraktiot (A + B) ovat graafisia, lämpötilasta tai paineesta riippuen, saadaan binaarikaaviot (katso yllä). Tämä erityinen muoto, yksinkertaisin, vastaa ihanteellisia ratkaisuja.
Voi palvella sinua: molaarinen tilavuus: käsite ja kaava, laskenta ja esimerkit"Soval" yläpuolella oleva alue vastaa höyryfaasia, kun taas alla oleva alue vastaa seoksen nestemäistä vaihetta. Huomaa, että kun komponentin 1 molaarinen fraktio tai on 0 (x1= 0), komponentin 2 tai B molaarinen fraktio on yhtä suuri kuin 1 (x2= 1), ja sitten höyrynpaine on velkaa vain B. Tästä lämpötilasta tulee b: n kiehumispiste.
Samaan aikaan toisessa päässä (oikealla), kun x2= 0, mutta x1= 1, höyrynpaine on vain. Tästä lämpötilasta tulee sen kiehumispiste.
Alempi soikea viiva vastaa kuplapistettä, joka on, kun ensimmäinen kupla ilmestyy, kun nestemäinen seos lämmitetään (kaavio ylöspäin). Ja ylempi viiva vastaa kastepistettä, joka on, kun höyryvaihe jäähtyy ja ensimmäinen pudotus tulee näkyviin (laskee kaaviossa).
Azeotropos
Monissa ei -ideaalisissa ratkaisuissa meillä on Azeotrops, jotka ovat seoksia, jotka haihtuvat säilyttäen koostumuksensa vakiona; eli ne haihtuvat ikään kuin ne olisivat puhdas yhdiste.
On mahdotonta "rikkoa" azeotrooppista koostumusta tislausvaiheiden kautta. Sen sijaan muita menetelmiä käytetään halutun komponentin puhtauden lisäämiseen.
Esimerkiksi etanoli-vesi-seos muodostaa azeotrooppisen 95-koostumuksen kanssa.4 etanolia. Tämä tarkoittaa, että tislausten kautta on mahdotonta saada etanolia, jonka pitoisuus on yli 95.4%; Siellä on aina 4.6% jäljellä oleva vesi. Jos halusit valmistaa absoluuttisen etanolin (100%), vaaditaan dehydratointimateriaalien tai muiden synteesireitit.
Binaarikaaviossa voimme nähdä azeotroopin läsnäolon, joka esittelee seuraavan muodon:
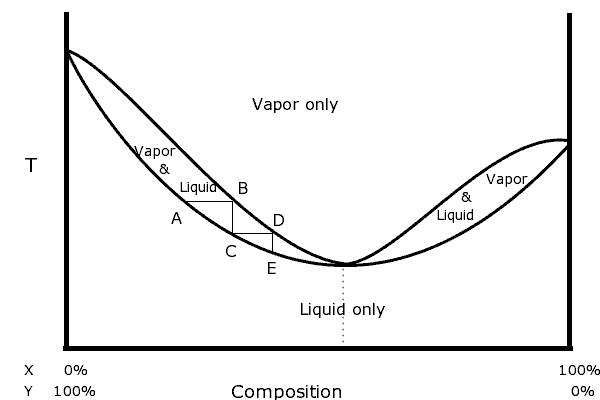 Binaarikaavio seoksesta, jolla on positiivinen atsotrooppinen. Lähde: Karlhahn English Wikipediassa, julkinen verkkotunnus, Wikimedia Common
Binaarikaavio seoksesta, jolla on positiivinen atsotrooppinen. Lähde: Karlhahn English Wikipediassa, julkinen verkkotunnus, Wikimedia Common Kaavion vasemmalla puolella voidaan nähdä, että ”soikea”, alueella, jolla meillä on nestemäinen höyryn tasapaino, voimme tislata peräkkäisissä vaiheissa (A, B, C, D ja E) saadaksemme yhä rikkaamman Seos haihtuneimmassa komponentissa (x tälle kaaviolle).
Azeotrooppisessa pisteessä x ja y ja kiehumisseos ikään kuin se olisi yksi aine, joten sillä ei ole väliä kuinka monta tislausta tehdään, sekä nesteellä että höyryllä on sama koostumus.
Voi palvella sinua: Molekyylinen kaava: Kuinka saada se ulos, esimerkkejä ja harjoituksiaOsittain sekoittuva
Osittain sekoittuneissa seoksissa ne muodostetaan lämpötilasta riippuen kaksi tunnistettavaa vaihetta: yksi rikas komponentti A ja toinen rikas komponentti B. Näiden tapausten binaarikaaviot ovat paljon tiukempia ja laajempia, koska niihin liittyy alueita, joilla höyry on samanaikaisesti yhdessä kahden vaiheen kanssa.
Sekoittumaton
Kun puhut sekoittumattomista seoksista, kukin komponentti käyttäytyy ikään kuin se olisi korkean puhtauden tilassa, koska se tuskin on vuorovaikutuksessa muiden molekyylien kanssa. Siksi näiden seosten höyrynpaine on yhtä suuri kuin:
Paurinko = P-Llaº + PB -º +··· PYllyttääº
Seos kiehuu lämpötilassa, joka on alhaisempi kuin puhtaiden komponenttien, koska sekoittumattoman seoksen paine on suurempi, koska se on yhtä suuri kuin kunkin komponentin paineiden summa puhtaassa tilassa. Lisää höyrynpainetta merkitsee sitä, että se on haihtuvampi, ja siksi kiehuu alhaisemmassa lämpötilassa.
Sovellukset
Tislaus
Tislauksissa, etenkin teollisuustasolla, nestemäisen höyryn tasapainon tieto on ensisijainen. Seoksen komponenteista ja sen vaihekaavioista voidaan laskea, kuinka monta ruokaa tarvitaan fraktiointitornin rakentamisessa mainittujen komponenttien oikeaan erottamiseen.
Vesihöyryn tislaus
Vesihöyry voidaan pumpata seoksen sisällä tislauksen alla. Kun kuplia vettä höyryä nesteen sisällä, seoksen höyrypaine nousee, joten se kiehuu alhaisemmassa lämpötilassa ja auttaa purkautumaan kaikkein haihtuvimmat komponentit (kuten olemukset).
Juoma lintu
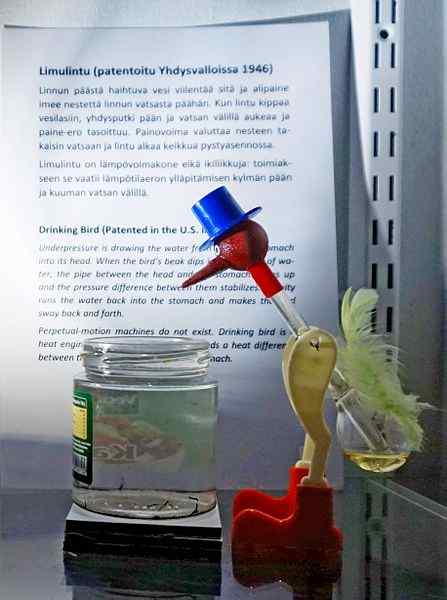 Lintu, yksi kaikkien aikojen nerokkaimmista leluista. Lähde: Tiia Monto, CC BY-SA 4.0, Wikimedia Commons
Lintu, yksi kaikkien aikojen nerokkaimmista leluista. Lähde: Tiia Monto, CC BY-SA 4.0, Wikimedia Commons Vaikka se ei ole juuri nestemäistä höyryn tasapainoa, totuus on, että juoma-linnun toiminnan takana useita termodynaamisia ilmiöitä on piilotettu.
Kun linnun pää on märkä, se alkaa jäähtyä, kun vesi haihtuu. Tämä lämpötilan lasku aiheuttaa paineen laskua lintu pään sisällä. Linnun pohjassa sijaitseva metyleenikloridi pyrkii tasapainottamaan paineet virtaaen ylös lasiputken läpi, joka yhdistää pään pään kanssa.
Neste nousee linnun päähän, jolloin se on raskaampi ja kallistus kehon eteenpäin. Lintu "juo vettä" ja höyrypaineet tasapainottavat. Tasapaino paineet, linnun lintu palaa pystysuoraan asentoon ja sykli toistetaan, kun pään vesi haihtuu uudelleen.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Walter J. Moore. (1962). Fysikaalinen kemia. (Neljäs painos). Longmanit.
- Wikipedia. (2020). Höyry-nestetasapaino. Haettu: vuonna.Wikipedia.org
- Ed Vitz et ai. (5. marraskuuta 2020). Höyry-nestetasapaino. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Limer Eric. (30. tammikuuta 2018). Absurdisti yksityiskohtainen selitys juomalaruslelusta. Toipunut: PopularMekaniikka.com
- Alicanten yliopisto. (S.F.-A. Aihe 4: Tasapainon laskenta. Tasapainokaaviot. [PDF]. Toipunut: Rua.UA.On

