Kemiallisen tasapainon selitys, tekijät, tyypit, esimerkit

- 2498
- 537
- Juan Breitenberg V
Hän kemiallinen tasapaino Se on tila, joka saavuttaa palautuvat kemialliset reaktiot, joissa pitoisuuksien tai reagenssien, eikä mukana olevien tuotteiden vaihtelua ei tuoteta. Sille on ominaista dynaaminen eikä staattinen; Eli molekyylit tai atomit jatkavat reagointia, mutta ylläpitävät samoja pitoisuuksia ajanjakson aikana.
Samanlainen tasapaino esitetään myös vaihemuutoksissa, vaikka linkkitaukoja ei olisi. Esimerkiksi neste voi olla tasapainossa sen höyryjen kanssa, samoin kuin kiinteä. Samoin kiinteä kiinteä kiinteä muodossa on tasapaino vesillä, jotka ympäröivät sitä, kun se on saostettu tai kiteytynyt.
 Kemianteollisuudessa kemiallisen tasapainon tuntemus on välttämätöntä synteesin saamiseksi paremmilla saannoilla. Lähde: Pxhere.
Kemianteollisuudessa kemiallisen tasapainon tuntemus on välttämätöntä synteesin saamiseksi paremmilla saannoilla. Lähde: Pxhere. Kun kemiallinen tasapaino on muodostettu, ei ole mahdollista saada enemmän muutoksia tai vastauksia, ellei sitä ole keskeytetä tai vaikuttavat ulkoisiin toimiin. Se on siten tuotteen synteesissä useita parametreja, kuten paine, tilavuus tai lämpötila, niin että tuotteen suurin määrä syntyy tasapainossa.
Muuten tuotteiden määrät ovat epätyydyttäviä; Eli reaktiosuorituskyky on huono. Siksi kemiallinen tasapaino on elintärkeä kemianteollisuudelle ja yleensä minkä tahansa synteesin suhteen sen mittakaavasta riippumatta.
Kemiallisessa tasapainossa voi olla enemmän tuotteita tai enemmän reagensseja. Kaikki riippuu siitä, missä tasapaino on siirretty. Kun otetaan huomioon useita tekijöitä, voit siirtää tasapainon kohti mitä tahansa kaksoisnuolen kahta suuntaa palautuvassa reaktiossa.
[TOC]
Kemiallisen tasapainon selitys
Ennen tasapainoa
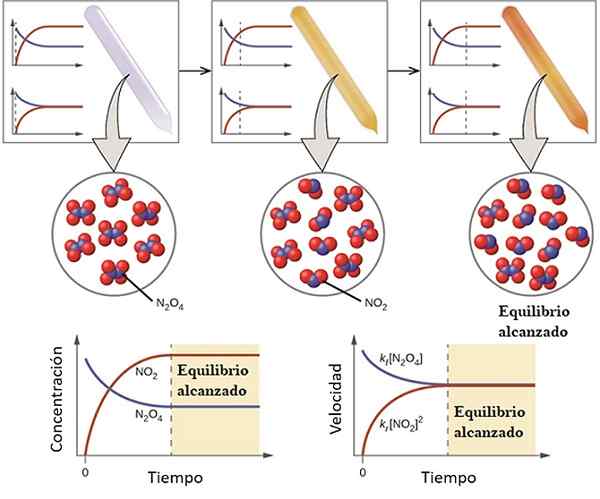 Esimerkki siitä, kuinka reaktio lähestyy tasapainoa. Lähde: OpenStax/CC by (https: // creativecommons.Org/lisenssit/by/4.0)
Esimerkki siitä, kuinka reaktio lähestyy tasapainoa. Lähde: OpenStax/CC by (https: // creativecommons.Org/lisenssit/by/4.0) Kemiallisen tasapainon ymmärtämiseksi harkitaan seuraavaa palautuvaa reaktiota:
N2JOMPIKUMPI4(g) ⇌ EI2(g)
Kaasu n2JOMPIKUMPI4 Se on väritön, kun taas kaasu ei2 esittelee ruskean tai ruskean värin. Jos tietty määrä n injektoidaan pieneen injektiopulloon tai astiaan2JOMPIKUMPI4, Tämä on väritöntä, kunnes tasapaino on muodostettu.
Yläkuvan vasemmalla puolella voidaan nähdä, että melkein kaikki molekyylit ovat n2JOMPIKUMPI4 ja että ei2 Se on nolla.
Näytä myös kaksi kuvaajaa, jotka edustavat sitä, mikä tasapainon suuntaus on, katkoviiva osoittaa sijaintia silloin, kun vain n injektoidaan2JOMPIKUMPI4. Kaavio vastaa pitoisuutta vs. Aika (alamäki) ja toinen vastaa kuvaajaa nopeudella Vs. Aika (oikea käsi).
N: n pitoisuus2JOMPIKUMPI4, [N2JOMPIKUMPI4] (sininen viiva) vähenee vähitellen, koska osa siitä dissosioituu tuottamaan ei -molekyylejä2. Siten, että se on ei2, [EI2] (punainen viiva), joka on alussa nolla, kasvaa pian kuin n2JOMPIKUMPI4 Erottaa.
Se on kuitenkin palautuva reaktio: osa no -molekyyleistä2 He liittyvät muotoon n2JOMPIKUMPI4. Siksi on kaksi reaktiota, suora ja käänteinen, jokaisella on omat nopeutensa.
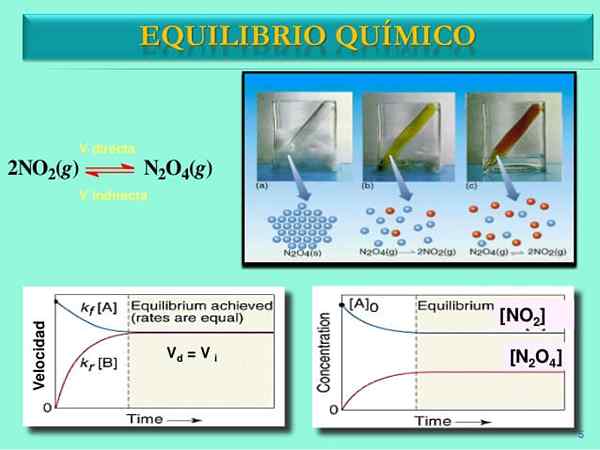 Lähde: Slideshare.netto
Lähde: Slideshare.netto Reaktionopeus
Aluksi N: n kulutusnopeus2JOMPIKUMPI4 on suurempi kuin ei2. On selvää, että sinulla on vain n2JOMPIKUMPI4, harvat molekyylit, jotka on muodostettu ei2 He tuskin voi reagoida. Tässä vaiheessa injektiopullo alkaa pistää oranssia, koska on sekoitus n2JOMPIKUMPI4 ja ei2.
Vähitellen, koska ei ole enemmän ei2 Tiellä ja että N -molekyylit2JOMPIKUMPI4 Ne dissosioituvat, kahden reaktion nopeudet vastaavat, vaikka pitoisuudet eroavat toisistaan. Eli ei2] on yleensä suurempi kuin [n2JOMPIKUMPI4], siksi punainen viiva on sinertävän viivan yläpuolella.
Voi palvella sinua: fysikaalis -kemialliset ominaisuudetHuomaa, että nopeudesta tulee tasavirta/dt, ts. Keskittymisen muutos ajan suhteen. Siksi kaksi c vs. t ja V vs. t eivät ole identtisiä.
Tasapainossa
Kun pari n2JOMPIKUMPI4-EI2 Aseta tasapaino, molempien reaktioiden nopeudet vastaavat ja saadaan seuraavat matemaattiset lausekkeet:
Vsuoraan = k1[N2JOMPIKUMPI4-
Vkäänteinen = k-1[EI2-2
Vsuoraan = Vkäänteinen
k -k -1[N2JOMPIKUMPI4] = k-1[EI2-2
k -k -1/k-1 = [Ei2-2/ [N2JOMPIKUMPI4-
K -k -Eq = [Ei2-2/ [N2JOMPIKUMPI4-
Tässä vaiheessa tie on värjätty jopa enemmän kuin ruskea, koska tasapaino on siirretty enemmän [ei2-. Eli kEq, Tasapainovakion on oltava suurempi kuin yksi ottaen huomioon korkeampi suhde, [ei2-2/ [N2JOMPIKUMPI4-.
Tasapainopitoisuuksissa [n2JOMPIKUMPI4] ja ei2] Ne pysyvät vakiona, kun molemmat reaktiot tapahtuvat samalla nopeudella: tietty määrä n on vain dissosioitunut2JOMPIKUMPI4, Sama määrä tuotetaan välittömästi tietyn määrän ei -reaktion vuoksi2.
Tästä syystä sanotaan, että kemiallinen tasapaino on dynaaminen: molekyylit n2JOMPIKUMPI4 ja ei2 He osallistuvat edelleen reaktioihin, vaikka pitoisuuksissaan ei tapahdu muutosta.
Ja koska ne ovat yhtä suuret reaktionopeudet molemmille aisteille, punaista ja sinertävää viivaa grafiikassa V vs. t Play vaakasuoralla viivalla.
Tasapainovakio
Edellisen reaktion tasapainovakio on aina sama, tietyssä lämpötilassa riippumatta siitä, kuinka paljon n2JOMPIKUMPI4 injektoidaan alussa tielle. Tämä on niin, vaikka n -sekoitus n injektoidaan suoraan2JOMPIKUMPI4 ja ei2, sitten jäljellä levossa, kunnes tasapaino saavuttaa.
Kun tasapaino saavutetaan ja pitoisuudet mitataan [n2JOMPIKUMPI4] ja ei2], suhde [ei2-2/ [N2JOMPIKUMPI4] antaa saman k: lleEq Tätä reaktiota varten. Mitä suurempi se on (Keq >> 1), sitä enemmän tuotteita on tasapainossa. Ja pienempi (Keq << 1), más reactivos habrá en el equilibrio.
Pitoisuudet [n2JOMPIKUMPI4] ja ei2] he eivät aina. Esimerkiksi, jos pieniä tilavuuksia injektoidaan injektiopulloon tai jos päinvastoin, ne injektoidaan näiden kaasujen torrentit reaktoriin, määrät vaihtelevat huomattavasti. Kuitenkin kEq Se pysyy samana, niin kauan kuin lämpötila on sama molemmissa prosesseissa.
K -k -Eq Se on alttiita lämpötilan muutoksille: korkeammalla lämpötilassa suurempi arvo on. Toisin sanoen korkeassa lämpötilassa, tasapainossa se pyrkii lisäämään tuotteita. Tämä on niin, ellei reaktiota ole eksoterminen, kuten seuraavassa osassa selitetään.
Kemialliseen tasapainoon vaikuttavat tekijät
Kemialliseen tasapainoon palautuvassa reaktiossa vaikuttavat tekijät ovat: pitoisuus, paine ja lämpötila.
- Pitoisuus
Palautuvassa reaktiossa Le Chatlierin periaatteen mukaan lisäämällä reagenssin konsentraatiota siirtyy kemiallisen tasapainon siirtämiseen oikealle, reaktiotuotteiden pitoisuuden lisäämiseksi, jotta voidaan lisätä reaktiotuotteita.
Päinvastoin, jos tuote lisätään reaktioon, kemiallinen tasapaino siirtyy vasemmalle reagenssien pitoisuuden lisäämiseksi. Jos seuraavaa reaktiota pidetään esimerkkinä:
C (s) +o2(g) ⇌ 2 Co (g)
Lisäämällä reagenssien pitoisuutta (C ja O2), Tasapaino siirtyy oikealle, toisin sanoen kohti hiilimonoksidituotteen (CO) muodostumista (CO). Mutta CA: n pitoisuuden lisääntyminen tuottaa vasemmalle olevan tasapainon siirtymisen C: n ja O: n pitoisuuden lisäämiseksi2.
Se voi palvella sinua: Karbonyyliryhmä: Ominaisuudet, ominaisuudet, nimikkeistö, reaktiivisuus- Paine
Kaasufaasissa kehitetyssä reaktiossa, tilavuuden tai siihen liittyvien kaasujen kohdistuvan painevaihtelujen vaihtelu tuottaa muutoksen tasapainossa riippuen reagenssien ja tuotteiden moolien lukumäärästä.
Jos reaktion komponenteilla (reagenssit ja tuotteet) on eroja reaktioon liittyvien moolien lukumäärässä, esimerkiksi typpidioksidin dimeroituminen (ei2)
2 Ei2(g) ⇌2JOMPIKUMPI4(g)
Reaktiossa kaasufaasiin kohdistuvan paineen nousu, seurauksena reaktion tilavuuden vähenemisestä tai ei, aiheuttaa kemiallisen tasapainon siirtymisen sivulle, jolla on vähemmän kaasumooleja. Tässä esimerkissä: tuote n2JOMPIKUMPI4.
Päinvastoin, paineen väheneminen tuottaa tasapainon siirtymisen reaktion puolelle, jolla on eniten kaasu -moolia. Annetussa esimerkissä se siirtyy kohti reagensseja (ei2), Paineen laskun torjumiseksi.
Jos soodafaasireaktiossa reagenssien moolit ovat yhtä suuret kuin tuotteiden moolit, paineen muutokset eivät vaikuta kemialliseen tasapainoon.
- Lämpötila
Endoterminen reaktio
Endotermisessä reaktiossa lämpöä voidaan pitää reagenssina, koska sen tarjonta on välttämätön reaktion esiintymiseksi:
A +Q ⇌ B
Q = toimitettu lämpö
Siksi endotermisessä reaktiossa lämpötilan noustessa tasapaino siirtyy oikealle. Samaan aikaan, kun lämpötila laskee, tasapaino siirtyy vasemmalle.
Lämpö on osa reagensseja, kuluttaa sen muuttumiseksi b: ksi.
Eksoterminen reaktio
Eksotermisessä reaktiossa syntyy lämpöä, tämä on reaktion tuote:
A ⇌ B +Q
Eksotermisessä reaktiossa lämpötilan noustessa tasapaino siirtyy vasemmalle (reagenssit), koska lämmöntuotanto kasvaa. Samaan aikaan, kun lämpötila laskee, tasapaino siirtyy oikealle (tuotteet).
Lämpö on osa tuotteita, kun lämpötila nousee, ympäristöön ei tarvitse lisätä lämpöä. Ja siksi tasapaino pyrkii hyödyntämään ylimääräistä lämpöä lisäämällä enemmän reagensseja; Tässä tapauksessa enemmän kuin.
Kemialliset tasapainotyypit
Reaktiokomponenttien fysikaalisesta tilasta riippuen kemiallinen tasapaino voi olla homogeeninen tai heterogeeninen.
Homogeeninen tasapaino
Tämän tyyppisessä tasapainossa, kaikki Reagensseilla ja tuotteilla on sama faasi- tai nestemäinen tila. Esimerkiksi:
N2(g) +3 h2(g) ⇌ 2 NH3(g)
Tässä on niin2, kuin h2 ja NH3 Ne ovat kaasumaisia aineita.
Heterogeeninen tasapaino
On olemassa, kun ei kaikki Reagensseilla ja tuotteilla on sama vaihe tai fyysinen kunto. Esimerkiksi:
2 Nahco3(s) ⇌ na2Yhteistyö3(s) +Co2(g) +h2O (g)
Täällä meillä on Nahco3 ja na NA2Yhteistyö3 kiinteinä aineina ja yhteistyössä2 ja h2Tai kaasuina tai höyryinä.
Kemiallisen tasapainon esimerkit
Etikkahapon dissosiaatio vedessä
Etikkahappo, CHO3COOH, dissosioituu veteen muodostaen tasapainon:
CH3COOH (AC) + H2Tai (l) ⇌ cho3Kujertaa-(AC) + H3JOMPIKUMPI+(AC)
Reaktio, jonka tasapainon vakiona kutsutaan happamuusvakioksi.
Isomerointijompikumpin butaania
Kaasu n-Butano voidaan isomeroida seuraavan palautuvan reaktion mukaan isomeerin isomeerin tuottamiseksi:
CH3CH2CH2CH3(g) ⇌ Cho3Ch (ch3-A2(g)
Typpioksidin muodostuminen ilmakehässä
Ilmakehässä typpioksidia voidaan muodostaa, vaikkakin tuskin typen ja ilman happea:
N2(g) + tai2(g) ⇌ 2no (g)
Se voi palvella sinua: mikä on miljööivalinta? (Laskentaesimerkkejä)KEq Tästä reaktiosta on 2,10-31 25 ºC: n lämpötilassa, niin halveksittava määrä NO muodostetaan.
ReaktiojompikumpiN hopeakomponentti Amonin kanssaYllyttääAc
Hopea -ionit, AG+, Ne voidaan suorittaa ammoniakkiin seuraavan palautuvan reaktion mukaisesti:
Ag+(Aurinko) + 2nh3(L) ⇌ [AG (NH3-A2-+(aurinko)
Ratkaisut
Harjoitus 1
Millainen kemiallinen tasapaino vastaa seuraavaa reaktiota?
2nocl (g) ⇌ 2no (g) + cl2(g)
Tämä reaktio vastaa homogeenista tasapainoa, koska kaikki mukana olevat aineet, NOCL, NO ja CL2, Ne ovat kaasuja.
Harjoitus 2
Samasta ylhäältävasta reaktiosta, mitä tasapainon muutosta voitaisiin odottaa, jos paine yhtäkkiä lisääntyi?
Lasketaan reagenssien moolit:
2NOCL
Meillä on 2 moolia NOCL: tä. Kerrotaan nyt tuotteiden moolit:
2no + cl2
Meillä on kolme moolia: kaksi ei ja yksi CL: stä2. Tuotteiden sivulla on enemmän kaasumaisia mooleja. Siksi paineen nousu aiheuttaa tasapainon siirtymisen vasemmalle puolelle NOCL: n muodostumista kohti. Tällä tavoin järjestelmä pyrkii pehmentämään paineen vaikutuksia, jotka suosittelevat NOCL: n muodostumista eikä ei ja Cl2.
Harjoitus 3
Saman reaktion ylhäältä olevaa reaktiota oletetaan, että huomattava määrä CL: tä injektoidaan yhtäkkiä2. Mitä tapahtuu tasapainottamiseksi?
Kun lisäät Cl: tä2 Reaktoriin tai säiliöön sen pitoisuus kasvaa reaktion tuotteena. Ja siksi tasapaino siirtyy takaisin vasemmalle, muodostaa enemmän NOCL: tä.
Harjoitus 4
Jos NOCL: n dissosiaatio 227 ºC: ssa on 4 tasapainon vakio 4.5 · 10-4, Mihin suuntaan tasapaino on siirretty?
Jälleen, kun se on kEq Alle 1 (4.5 · 10-4 < 1), en el equilibrio se espera que haya más NOCl que NO o Cl2, Koska se on siirretty vasemmalle.
Harjoitus 5
Seuraavan tasapainon reaktion mukaan:
[Co (Voi2-A6-2+(AC) +4Cl-(Ac) +q ⇌ [cocl4-2-(AC) +6H2Tai (l)
Ja tietäen, että kompleksi [Co (OH2-A6-2+ Se on vaaleanpunainen ja että kompleksi on [cocl4-2- Se on sinertävää, mitä muutoksia odotat, jos lämmität astian [Co (OH2-A6-2+? Mitä odotat nähdä, laittaisin sen lämmityksen jälkeen sen kylpyhuoneeseen jäällä?
Reaktio on endoterminen, koska se imee lämpöä, että reagenssina. Siksi lämmitettäessä astiaa [CO (OH2-A6-2+, Tasapaino siirtyy oikealle kohti [cocl: n muodostumista4-2-. Sinertävä vaaleanpunainen väri muuttuu.
Sitten, jos sinertävä värisäiliö on [cocl4-2- Se sijoitetaan kylpyhuoneeseen, jossa on jää, reaktio siirtyy nyt vasemmalle, kohti CO: n muodostumista (OH2-A6-2+-
[COCL4-2-(AC) +6H2Tai (l) ⇌ [Co (OH2-A6-2+(AC) +4Cl-(AC) +Q
Tämä johtuu siitä, että käänteinen reaktio on eksoterminen, sillä siinä on lämpöä tuotena. Siksi jäähdytettäessä astiaa [cocl4-2- Sininen, kompleksi [Co (OH (OH2-A6-2+, Ja vaaleanpunainen väri ilmestyy uudelleen.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- EMEDICAL PREP. (S.F.-A. Tasapainotyypit. Toipunut: emedicprep.com
- Lumen Rajaton kemia. (S.F.-A. Kemiallisen tasapainon mukaiset tekijät. Toipunut: kurssit.Lumenarning.com
- Wikipedia. (2020). Kemiallinen tasapaino. Haettu: vuonna.Wikipedia.org
- Kemian librettexts. (24. toukokuuta 2020). Vekvibriumlaskelmat - Sub -havainnollistavat tutkimukset. Palautettu: Chem.Librettexts.org
- Meyers Amy. (2020). Tasapaino: kemiallinen ja dynaaminen. Opiskelu. Toipunut: Opiskelu.com
- Helmestine, Anne Marie, PH.D -d. (11. helmikuuta 2020). Kemiallinen tasapaino kemiallisissa reaktioissa. Toipunut: Admingco.com
- « Guatemalan kulttuurien ominaisuudet, perinteet ja tapat
- Säätiöelektroforeesi, tekniikka, mihin se on, esimerkkejä »

