Mikroskooppiset asteikon ominaisuudet, laskenta hiukkaset, esimerkit
- 2223
- 471
- Alonzo Kirlin
Se Mikroskooppinen asteikko Sitä käytetään mittaamaan koot ja pituudet, joita ei voida nähdä paljaalla silmällä ja jotka ovat millimetrin alapuolella. Metrisen järjestelmän mikroskooppiset asteikot ovat: korkeammasta alhaisimmasta:
- Millimetri (1 mm), joka on senttimetrin kymmenesosa tai tuhannes metriä. Tässä on asteikko, joka meillä on yksi kehon suurimmista soluista, joka on munasolu, jonka koko on 1,5 mm.
 Kuvio 1. Punasolut ovat mikroskooppisia asteikkoja soluja. Lähde: Pixabay
Kuvio 1. Punasolut ovat mikroskooppisia asteikkoja soluja. Lähde: Pixabay - Kymmenesosa millimetristä (0,1 mm). Tämä on ihmisen hiusten paksuuden tai halkaisijan mittakaava.
- Mikrometri tai Micra (1μm = 0,001 mm). Tässä mittakaavassa ovat kasvi- ja eläinsolut ja bakteerit.
Kasvisolut ovat luokkaa 100 μm. Eläinsolut ovat kymmenen kertaa vähäisiä, se on luokkaa 10 μm; Kun taas bakteerit ovat 10 kertaa vähemmän kuin eläinsolut ja ne ovat luokkaa 1 μm.
[TOC]
Nanometrinen asteikko
Mikroskooppista asteikkoa on vielä pienempi. Seuraavaksi näemme joitain tärkeimmistä nanometrisistä toimenpiteistä:
- Nanometri (1 ηm = 0,001 μm = 0,000001 mm) on millimetrin miljoona. Tällä asteikolla on joitain viruksia ja molekyylejä. Virukset ovat luokkaa 10ηm ja 1ηm: n luokan molekyylit.
- Angstrom (1å = 0,1ηm = 0,0001 μm = 10-7mm). Tämä mitta muodostaa atomi -asteikon tai koon.
- Fantometri (1FM = 0,00001å = 0,000001uksi = 10-12mm). Tämä on atomien ytimien mittakaava, joka on 10 tuhatta 100 tuhatta kertaa pienempiä kuin atomi. Pienestä koosta huolimatta ydin konsentroi kuitenkin 99,99% atomimassasta.
- Atomi -ytimessä on pienempiä asteikkoja, koska ne koostuvat hiukkasista, kuten protoneista ja neutroneista. Mutta niitä on enemmän: nämä hiukkaset puolestaan muodostavat perusteellisemmat hiukkaset, kuten kvarkit.
Instrumentit mikroskooppiseen havaintoon
Kun esineet ovat millimetrin ja mikrometrisen asteikon (1 mm - 0,001 mm) välillä, ne voidaan havaita optisella mikroskoopilla.
Jos esineet tai rakenteet ovat nanometrien ja angstromin välillä, tarvitaan elektronisia tai nanoskooppimikroskooppeja.
Elektronisessa mikroskopiassa käytetään valon korkean energian elektroneja, joiden aallonpituus on paljon pienempi kuin valo. Elektronisen mikroskoopin haitta on, että se ei ole mahdollista.
Voi palvella sinua: magneettinen sokki: yksiköt, kaavat, laskenta, esimerkitToisaalta laservaloa käytetään nanoskoopissa, ja sillä on etu elektroniseen mikroskopiaan nähden, että rakenteita ja molekyylejä voidaan katsoa ja tallentaa elävän solun sisään.
Nanoteknologia on tekniikka, jolla piirit, rakenteet, osat ja jopa moottorit valmistetaan asteikolla, jotka vaihtelevat nanometristä atomi -asteikkoon.
Mikroskooppiset ominaisuudet
Fysiikassa ensimmäisessä lähestymistavassa aineen ja järjestelmien käyttäytymistä tutkitaan makroskooppisesta näkökulmasta. Tästä paradigmasta asia on äärettömän jakava jatkumo; Ja tämä näkökulma on pätevä ja riittävä monille arjen tilanteille.
Joillakin makroskooppisen maailman ilmiöillä on kuitenkin selitys vain, jos asian mikroskooppiset ominaisuudet otetaan huomioon.
Mikroskooppisessa näkökulmassa aineen molekyyli- ja atomirakenne otetaan huomioon. Toisin kuin makroskooppinen lähestymistapa, tässä mittakaavassa on rakeinen rakenne, jossa on reikiä ja tiloja molekyylien, atomien välillä ja jopa näiden sisällä.
Mikroskooppisen fysiikan näkökulman toinen ominaisuus on, että aineenpala riippumatta siitä, kuinka pieni, koostuu valtavasta määrästä hiukkasia, jotka on erotettu toisistaan ja jatkuvassa liikkeessä.
-Aine on valtava tyhjyys
Pienessä piirakassa.
Eli mikroskooppisessa asteikolla oleva aine on valtava tyhjiö, jossa on atomien ja ytimien pitoisuuksia, jotka vievät hyvin pienen osan kokonaistilavuudesta kokonaismäärästä. Tässä mielessä mikroskooppisella asteikolla on samanlainen kuin tähtitieteellinen asteikko.
Makroskooppiset esineet atomin löytämiseen
Ensimmäiset kemikaalit, jotka olivat alkemisteja, huomasivat, että materiaalit voivat olla kahta tyyppiä: puhdasta tai yhdisteitä. Tämä saavutti kemiallisten elementtien idean.
Se voi palvella sinua: Painegradientti: Mikä se on ja miten se lasketaanEnsimmäiset kemialliset elementit havaittiin. Ajan myötä heidät löydettiin enemmän siinä määrin kuin löydettiin aineita, jotka eivät pystyneet hajoamaan muihin.
Sitten elementit luokiteltiin niiden ominaisuuksien ja ominaisuuksien mukaan metalleissa ja ei -metallissa. Kaikki ne, joilla oli samanlaisia kemiallisia ominaisuuksia ja affiniteettia.
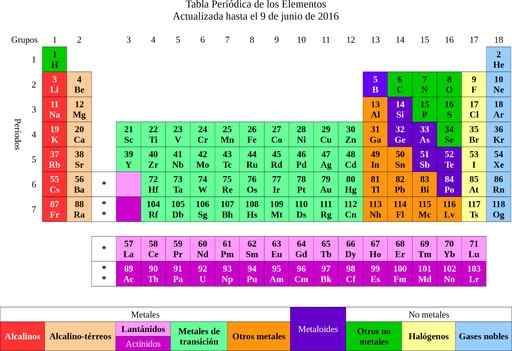 Kuva 2. jaksollinen elementtitaulukko. Lähde: Wikimedia Commons.
Kuva 2. jaksollinen elementtitaulukko. Lähde: Wikimedia Commons. Elementeistä se meni atomien ajatukseen, sanaan, joka tarkoittaa jakamista. Pian myöhemmin tutkijat huomasivat, että atomilla oli rakenne. Lisäksi atomeilla oli kahden tyyppinen sähkövaraus (positiivinen ja negatiivinen).
Subatomiset hiukkaset
Rutherfordin kokeissa, joissa hän pommitti ohuen kultalevyn atomeja alfahiukkoilla, paljastettiin atomin rakenne: pieni positiivinen ydin, jota ympäröivät elektronit.
He jatkoivat yhä enemmän energiahiukkasten atomien pommittamista ja vielä tehdään mikroskooppisen maailman salaisuuksien ja ominaisuuksien selvittämiseksi yhä enemmän pienemmässä mittakaavassa.
Tällä tavoin saavutettiin vakiomalli, joka osoittaa, että todelliset alkuainehiukkaset ovat niitä, joista atomit koostuvat. Atomit puolestaan aiheuttavat elementtejä, nämä yhdisteille ja kaikille tunnetuille vuorovaikutuksille (paitsi gravitaatio). Kaiken kaikkiaan on 12 hiukkasia.
Näillä perustavanlaatuisilla hiukkasilla on myös jaksollinen taulukko. Ryhmiä on kaksi: spin ½ fermioniset hiukkaset ja bosonic. Bosonic vastaa vuorovaikutuksesta. Fermionikat ovat 12 ja ovat ne, jotka aiheuttavat protoneja, neutroneja ja atomeja.
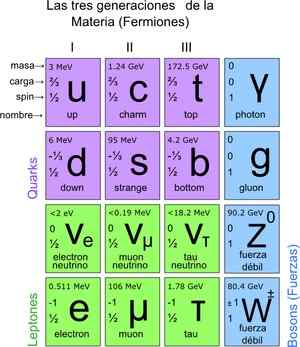 Kuva 3. Perushiukkaset. Lähde: Wikimedia Commons.
Kuva 3. Perushiukkaset. Lähde: Wikimedia Commons. Kuinka laskea hiukkaset mikroskooppisessa mittakaavassa?
Ajan myötä kemistit löysivät elementtien suhteelliset massat tarkista mittauksista kemiallisissa reaktioissa. Esimerkiksi, voitaisiin määrittää, että hiili on 12 kertaa raskaampi kuin vety.
Määritettiin myös, että vety on kevyin elementti, joten tälle elementille annettiin suhteellinen massa 1.
Toisaalta kemikaalit, joita tarvitaan reaktioon osallistuvien hiukkasten lukumäärän tuntemiseksi, niin kumpikaan reagenssi ei puuttu. Esimerkiksi vesimolekyyli vaatii kaksi vetyatomia ja yhden hapen.
Voi palvella sinua: aaltoilevat ilmiötTästä taustasta syntyy mol -käsite. Yksi aine minkä tahansa aineen mol on kiinteä määrän hiukkasia, jotka vastaavat sen molekyylin tai atomisimassan grammissa. Siten määritettiin, että 12 grammaa hiiltä on sama lukumäärä hiukkasia kuin 1 gramma vety. Tämä luku tunnetaan nimellä Avogadro -numero: 6,02 x 10^23 hiukkasia.
-Esimerkki 1
Laske kuinka monta kultatomia on 1 grammaa kultaa.
Ratkaisu
On tiedossa, että kullan atomipaino on 197. Nämä tiedot löytyvät jaksollisesta taulukosta ja osoittavat, että kultatomi on 197 kertaa raskaampi kuin vety ja 197/12 = 16 416 kertaa raskaampi kuin hiili.
Kulta -moolilla on 6,02 × 10^23 atomia, ja siinä on grammina ilmaistu atomipaino, ts. 197 grammaa.
Grammassa kultaa on 1/197 moolia kultaa, eli 6,02 × 10^23átomos/197 = 3,06 x10^23 Kultatomit.
-Esimerkki 2
Määritä kalsiumkarbonaattimolekyylien lukumäärä (Caco3), että tästä aineesta on 150 grammaa. Sano myös kuinka monta kalsiumiatomia, kuinka monta hiiltä ja kuinka monta happea tässä yhdisteessä on.
Ratkaisu
Ensimmäinen asia on määrittää kalsiumkarbonaatin molekyylimassa. Jaksoon taulukko osoittaa, että kalsiumin molekyylipaino on 40 g/mol, hiili 12 g/mol ja happi 16 g/mol.
Sitten molekyylimassa (caco3) Ole:
40 g/mol + 12 g/mol + 3 x 16 g/mol = 100 g/mol
Jokainen 100 grammaa kalsiumkarbonaattia on 1 mol. Sitten 150 grammaa vastaa 1,5 moolia.
Jokaisessa karbonaattimolissa on 6,02 x 10^23 karbonaattimolekyyliä, joten karbonaatin 1,5 moolissa on 9,03 x 10^23 molekyyliä.
Yhteenveto, 150 grammassa kalsiumkarbonaattia on:
- 9,03 x 10^23 kalsiumkarbonaattimolekyylit.
- Kalsiumiatomit: 9,03 x 10^23 .
- Myös 9,03 x 10^23 hiiliatomia
- Lopuksi, 3 x 9,03 x 10^23 happiatomia = 27,09 x 10^23 happiatomia.
Viitteet
- Sovellettu biologia. Mitkä ovat mikroskooppiset toimenpiteet?. Palautettu: YouTube.com
- Kemiallinen koulutus. Makroskooppiset, submikroskooppiset ja symboliset esitykset asiasta. Toipunut: Scielo.org.MX.
- Garcia a. Interaktiivinen fysiikan kurssi. Makrovaltiot, mikrometrit. Entropia. Haettu osoitteesta: SC.Ehu.On
- Aineen mikroskooppinen rakenne. Toipunut: Alipso.com
- Wikipedia. Mikroskooppinen taso. Toipunut: Wikipedia.com

