Absorptiospektri

- 4959
- 549
- Ronald Reilly
 Näkyvä valonspektri. Lähde: Wikimedia Commons
Näkyvä valonspektri. Lähde: Wikimedia Commons Mikä on absorptiospektri?
Eräs Absorptiospektri Se on valon vuorovaikutus materiaalin tai aineen kanssa missä tahansa sen fyysisissä tiloissa. Vuorovaikutus sisältää laajan segmentin sähkömagneettisen säteilyn aallonpituuksien ja energian alueelta.
Toisin sanoen absorptiospektri heijastaa sitä sähkömagneettisen säteilyn osuutta, jonka tietty materiaali absorboi taajuusalueella.
Tässä mielessä jotkut kiinteät aineet, nesteet tai kaasut voivat absorboida erilaisia energioita tai aallonpituuksia ultraviolettisäteilystä, jota seuraa näkyvä valo, säteilyyn tai infrapunavaloon, porrastettu mikroaaltoaallonpituuksiin.
Ihmisen silmä havaitsee vain aineen vuorovaikutuksen näkyvän valon kanssa. Se pystyy myös pohtimaan valkoisen valon diffraktiota prisman tai väliaineen kautta sen värikkäissä komponenteissa (ylivoimainen kuva).
Jos kevyt säde on "saalis" kulkemisen jälkeen materiaalin läpi ja analysoidaan, tiettyjen värillisten vyöhykkeiden puuttuminen löytyy. Toisin sanoen mustia raitoja havaitaan sen taustan kanssa vastakkain.
Tämä on absorptiospektri, ja sen analyysi on olennaista instrumentaalisessa analyyttisessä kemiassa ja tähtitieteessä.
Atomin imeytyminen
Yläkuvassa esitetään tyypillinen elementtien tai atomien absorptiospektri. Huomaa, että mustat raidat edustavat absorboituja aallonpituuksia, kun taas muut lähetetään. Tämä tarkoittaa, että päinvastoin, atomilähetysspektri näyttäisi mustalta kaistalta, jolla on säteilevät värit.
Mutta mitkä ovat nuo raidat? Kuinka tietää, absorboivatko absorboivat tai pääsevät (aiheuttamatta fluoresenssia tai fosforesenssia)? Vastaukset ovat atomien sallimissa elektronisissa tiloissa.
Voi palvella sinua: Vähimmäiskaava: Kuinka saada vähimmäiskaava, esimerkit ja harjoituksetElektroniset siirtymät ja energia
Elektronit kykenevät siirtymään pois ytimestä, jättäen sen positiivisesti ladattuna matkustaessaan pienemmältä energian kiertoradasta yhteen suurempaan energiaan. Tätä varten, kvanttifysiikan selittämä, absorboi fotoneja spesifistä energiaa mainitun elektronisen siirtymisen suorittamiseksi.
Siksi energia kvantisoituu, eikä absorboi fotonin väliainetta tai kolme neljäsosaa, mutta taajuusarvot (ν) tai betoniaallonpituudet (λ).
Kun elektroni on innostunut, se ei pysy rajoittamattomana suuremman energian elektronisessa tilassa. Vapauta energia fotonin muodossa, ja atomi palaa perus- tai alkuperäiseen tilaansa.
Riippuen absorboituneista fotoneista kirjataan, absorptiospektri. Ja jos liikkeeseen lasketut fotonit kirjataan, tulos on päästöspektri.
Tätä ilmiötä voidaan havaita kokeellisesti, jos pehmeät tai atomisoidut näytteet lämmitetään elementistä. Tähtitieteessä, vertaamalla näitä spektrejä, tähden koostumus voidaan tietää, ja jopa sen sijainti liittyy maahan.
Näkyvä spektri
Kuten kuvassa voidaan nähdä, näkyvä spektri sisältää värit violetista punaiseen ja kaikki sen sävyt suhteessa siihen, kuinka paljon materiaali imee (tummat vivahteet).
Punaisen valon aallonpituudet vastaavat 650 nm: n arvoja eteenpäin (kunnes katoaa infrapunasäteily).
Ja vasemmassa päässä violetti ja violetti sävyt peittävät aallonpituusarvot jopa 450 nm. Näkyvä spektri kattaa sitten 400 - noin 700 nm.
Kun λ kasvaa, fotonin taajuus pienenee ja siksi sen energia. Siten violettivalolla on suurempi energia (pienemmät aallonpituudet) kuin punaisella valolla (korkeammat aallonpituudet).
Voi palvella sinua: Bromi: Historia, rakenne, elektroninen kokoonpano, ominaisuudet, käyttöSiksi materiaali, joka absorboi violettia valoa.
Kun materiaali absorboi violettivärin, se käyttää vihertävän keltaista väriä, mikä tarkoittaa, että sen elektronit suorittavat erittäin energiansiirtymiä. Ja kun materiaali imee punaisen värin, vähemmän energian, se heijastaa sinertävää vihreää väriä.
Kun atomi on erittäin stabiili, se esittelee yleensä erittäin kaukaiset elektroniset tilat energiassa, ja siten on absorboitava fotoneja suuremmasta energiasta elektronisten siirtymien sallimiseksi:
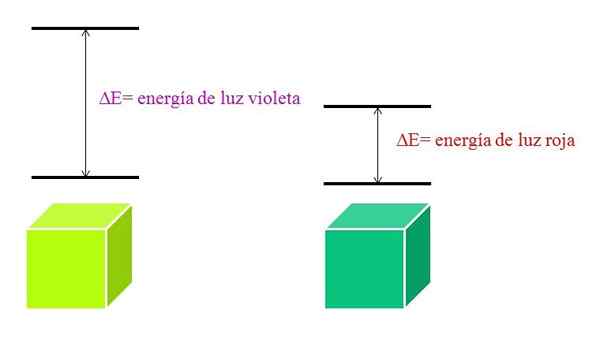 Violetin valon ja punaisen valon energioiden kaavio. Lähde: Gabriel Bolívar
Violetin valon ja punaisen valon energioiden kaavio. Lähde: Gabriel Bolívar Molekyylien absorptiospektri
Molekyyleillä on atomeja, ja ne absorboivat myös sähkömagneettisen säteilyn. Niiden elektronit ovat kuitenkin osa kemiallista sidosta, joten niiden siirtymät ovat erilaisia. Yksi molekyylin kiertoradan teorian suurista voitoista on kyetä yhdistämään absorptiospektrit kemiallisen rakenteen kanssa.
Siten yksinkertaisilla, kaksinkertaisilla, kolminkertaisilla, konjugoituilla linkillä ja aromaattisilla rakenteilla on omat elektroniset tilat, absorboivat hyvin spesifiset fotonit.
Molekyylien absorptiospektrien molekyylien absorptiospektrillä on useita atomeja.
Näiden spektrien ansiosta yhdiste voidaan karakterisoida, tunnistaa ja jopa monimuuttuja -analyysillä, kvantifioida se.
Metyleenisininen
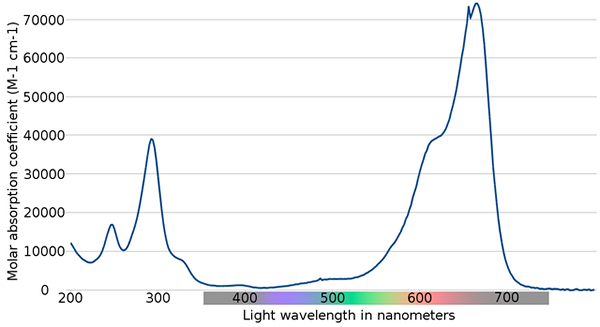 Metyleenin sininen spektri. Lähde: Wikimedia Commons
Metyleenin sininen spektri. Lähde: Wikimedia Commons Yläkuvassa on esitetty sinisen metyleenin indikaattorin spektri. Kuten nimensä huomauttaa, se on sininen, mutta voidaanko se tarkistaa sen absorptiospektrillä?
Voi palvella sinua: fyysiset muutoksetHuomaa, että 200–300 nm: n aallonpituuksien välillä on nauhoja. Välillä 400 - 500 nm, ei melkein ole absorptiota, ts. Se ei absorboi violetti-, sinisiä tai vihreitä värejä.
Se esittelee kuitenkin voimakkaan absorptiokaista.
Näin ollen ja ottaen huomioon molaaristen imeytymisten korkeat arvot, metyleenisillä on voimakas sininen väri.
Klorofiilit A ja B
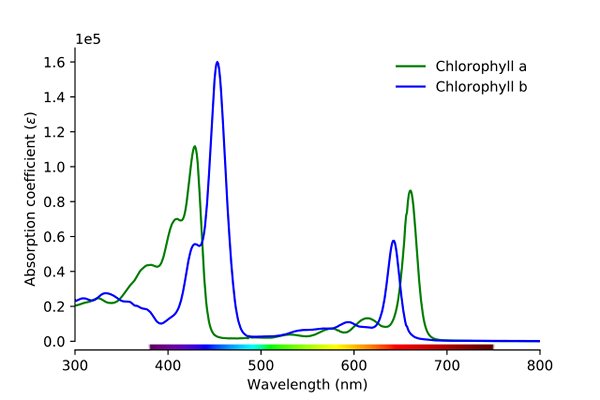 Klorofyllin imeytymisspektri A ja B. Lähde: Wikimedia Commons
Klorofyllin imeytymisspektri A ja B. Lähde: Wikimedia Commons Kuten kuvassa voidaan nähdä, vihreä viiva vastaa klorofylli A: n absorptiospektriä, kun taas sininen viiva vastaa klorofyllin B.
Ensinnäkin kaistat, joissa mooliset imeytymiset ovat korkeammat, tässä tapauksessa vasemmalla olevat, välillä 400 - 500 nm. Klorofylli A voimakkaasti absorboivia violetteja värejä, kun taas klorofylli B (sininen viiva) tekee sen sinisellä värillä.
Imettämällä klorofylli B noin 460 nm (sininen), keltainen väri heijastuu. Toisaalta se absorboi myös voimakkaasti, noin 650 nm, oranssi valo, mikä tarkoittaa, että sillä on väri sininen. Jos keltainen ja sininen sekoitetaan, se johtaa vihreään väriin.
Ja lopuksi, klorofylli A imee sinertävä violetti väri ja myös punainen valo noin 660 nm. Siksi sillä on vihreä "pehmeä" väri keltaisella.
Viitteet
- Observatoire de paris (S.F.-A. Erilaisia spektrejä. Haettu keskimäärin4.OSPPM.fr
- Ranals University Campus (S.F.-A. Spektrofometria: biomolekyylien absorptiospektrit ja kolorimetrinen kvantifiointi. UCO toipui.On

