Ominaisuuksien ensisijainen rakenne
- 3911
- 309
- Arthur Terry II
Se ensisijainen rakenne proteiineja Se on järjestys, jossa käsittävien polypeptidien aminohapot on järjestetty. Proteiini on biopolymeeri, jonka on muodostanut α-aminohappojen monomeerit, jotka on yhdistynyt peptidisidoksien kautta. Jokaisella proteiinilla on selkeä sekvenssi näistä aminohapoista.
Proteiinit suorittavat valtavan biologisten toimintojen monimuotoisuuden, mukaan lukien muoto ja säilyttävät solujen eheyden sytoskeleton kautta, puolustavat outojen aineiden runkoa vasta -aineiden avulla ja katalysoivat organismin kemiallisia reaktioita entsyymien kautta.
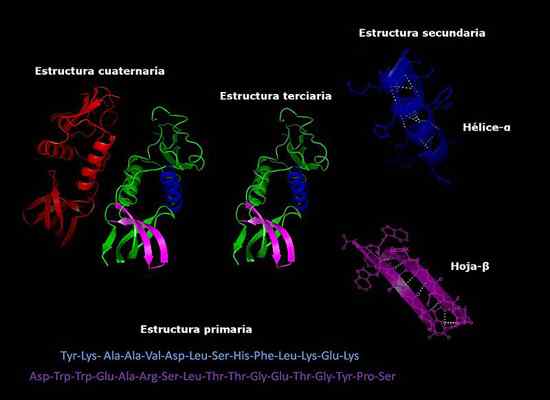
 Proteiinien primaariset, sekundaariset, tertiääriset ja kvaternääriset rakenteet, kolmen dimensioinen konformaatio. Otettu ja muokattu osoitteesta: Alejandro Porto [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)].
Proteiinien primaariset, sekundaariset, tertiääriset ja kvaternääriset rakenteet, kolmen dimensioinen konformaatio. Otettu ja muokattu osoitteesta: Alejandro Porto [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Tällä hetkellä proteiinien koostumuksen määrittäminen ja aminohappojen (sekvensointi) järjestys on nopeampi kuin vuosia sitten. Nämä tiedot talletetaan kansainvälisiin elektronisiin tietokantoihin, joihin voidaan käyttää Internetin kautta (GenBank, PIR).
[TOC]
Aminohappoja
Aminohapot ovat molekyylejä, jotka sisältävät aminohirron ja karboksyylihapporyhmän. Α-aminohappojen tapauksessa niillä on keskeinen hiiliatomi (hiili α), johon ne ovat yhtenäisiä, sekä aminoryhmä että karboksyyliryhmä, vetyatomin ja erottuvan R-ryhmän lisäksi, jota kutsutaan puolelle ketju.
Tämän a-hiilen konfiguraation vuoksi muodostuneet aminohapot, jotka tunnetaan nimellä a-aminohapot, ovat kiraalisia. On olemassa kahta muotoa, jotka ovat peilikuvia toisistaan ja joita kutsutaan enantiomeereiksi l ja d.
Kaikki elävien olentojen proteiini muodostetaan 20 a-aminohappojen konfiguraatiolla l. Näiden 20 aminohapon sivuketjut ovat erilaisia ja niillä on suuri kemiallisten ryhmien monimuotoisuus.
Periaatteessa a-aminohapot voidaan ryhmitellä (mielivaltaisesti) sivuketjun tyypistä seuraavalla tavalla.
Alifaattiset aminohapot
Joidenkin kirjoittajien, glysiinin (GLI), alaniinin (siipi), Valine (Val), Leucina (LEU) ja isoleusiinin (ILE) mukaan ne sisältävät ne. Muita kirjoittajia ovat myös metioniini (Met) ja proliini (Pro).
Voi palvella sinua: fosfolipidit: ominaisuudet, rakenne, toiminnot, tyypitAminohapot sivuketjuilla, jotka sisältävät hydroksyyliä tai rikkiä
Se sisältää seriini (SER), kysteiini (CYS), Treonina (THR) ja myös metioniini. Joidenkin kirjoittajien mukaan ryhmän tulisi sisältää vain oleminen ja Thr.
Sykliset aminohapot
Vain proliinin integroima, joka, kuten jo toteaa, muut tekijät sisällyttävät alifaattisiin aminohappoihin.
Aromaattiset aminohapot
Fenyylialaniini (PHE), tyrosiini (Tyr) ja Triphafano (TRP).
Emäksiset aminohapot
Histidiini (hänen), lysiini (Lys) ja Arginina (Arg)
Happamat aminohapot ja sen amidit
Se sisältää asparagiinihappoja (ASP) ja glutamiinia (GLU) ja myös aspargiinia (ASN) ja glutamiinia (GLN). Jotkut kirjoittajat erottavat jälkimmäisen ryhmän kahteen; Toisaalta happamien aminohappojen (kaksi ensimmäistä) ja toisaalta ne, jotka sisältävät karboksyyliamidia (loput kaksi).
Peptidilinkit
Aminohapot voivat liittyä toisiinsa peptidilinkkien kautta. Nämä linkit, joita kutsutaan myös AMIDA-linkeiksi, on muodostettu yhden aminohapon a-amino-ryhmän ja toisen a-karboksyyliryhmän välillä. Tämä liitto muodostuu vesimolekyylin menetyksestä.
Kahden aminohapon välinen liitto johtaa dipéptidin muodostumiseen, ja jos uusia aminohappoja lisätään, peräkkäin, Tripid, Tetrapéptides ja niin edelleen.
Pienen määrän aminohappojen muodostamia polypeptidejä saavat oligopeptidien yleisen nimen, ja jos aminohappojen lukumäärä on korkea, niin polypeptidejä kutsutaan.
Jokainen polypeptidiketjuun lisätty aminohappo vapauttaa vesimolekyylin. Aminohapon osaa, joka on menettänyt H+ tai OH- unionin aikana, kutsutaan muuksi aminohappoksi.
Suurin osa näistä oligopeptidi- ja polypeptidiketjuista esiintyy toisessa päässä aminoterminaalinen (N-terminaalinen) ryhmä ja toisessa A-terminaalinen karboksyyli (C-terminaalinen). Tämän lisäksi ne voivat sisältää monia ionisoitavia ryhmiä aminohappojätteen sivuttaisten ketjujen välillä. Tämän vuoksi polyanfoliiteja pidetään.
Voi palvella sinua: Campeche -kasvisto ja eläimistö: edustavat lajit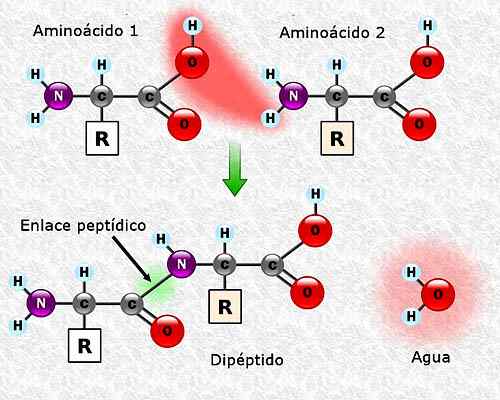 Peptidiyhteyden muodostuminen kahden aminohapon välillä. Otettu ja muokattu osoitteesta: Alejandro Porto [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)].
Peptidiyhteyden muodostuminen kahden aminohapon välillä. Otettu ja muokattu osoitteesta: Alejandro Porto [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Aminohapposekvenssi
Jokaisella proteiinilla on tietty aminohappojätteen sekvenssi. Tämä järjestys tunnetaan proteiinin ensisijaisena rakenteena.
Kunkin organismin jokainen yksittäinen proteiini on spesifinen lajeille. Eli ihmisen myoglobiini on identtinen toisen ihmisen kanssa, mutta sillä on pieniä eroja muiden nisäkkäiden myoglobiinien kanssa.
Proteiini sisältää aminohappojen määrä ja tyypit ovat yhtä tärkeitä kuin näiden aminohappojen sijainti polypeptidiketjussa. Proteiinien tuntemiseksi biokemistien on ensin eristettävä ja puhdistettava jokainen tietty proteiini, sitten tehtävä aminohappopitoisuuden analyysi ja lopulta määritettävä sen sekvenssi.
Proteiinien eristämiseksi ja puhdistamiseksi on olemassa erilaisia menetelmiä, joiden joukossa ovat: sentrifugointi, kromatografia, geelisuodatus, dialyysi ja ultrafiltraatio sekä tutkimuksessa käytettyjen proteiinien liukoisuusominaisuuksien käyttö tutkimuksessa.
Proteiineissa olevien aminohappojen määrittäminen suoritetaan kolmen vaiheen jälkeen. Ensimmäinen on rikkoa peptidisidokset hydrolyysillä. Myöhemmin seoksesta peräisin olevat aminohapot erityyppiset aminohapot erotetaan; Ja lopuksi, jokainen saadut aminohappotyypit kvantifioidaan.
Proteiinin primaarirakenteen määrittämiseksi voidaan käyttää erilaisia menetelmiä; Mutta tällä hetkellä eniten käytettyjä on Edmanin menetelmä, joka koostuu pohjimmiltaan N-terminaalisen aminohapon merkinnästä ja erottamisesta muusta ketjusta toistuvasti ja tunnistaa jokainen aminohappo, joka vapautuu erikseen.
Proteiinin koodaus
Proteiinien ensisijainen rakenne on koodattu organismien geeneihin. Geneettinen tieto sisältyy DNA: hon, mutta proteiinien translaation on ensin kirjoitettava RNM -molekyyleille. Jokainen nukleotidikolmio (kodoni) koodaa aminohappoa.
Voi palvella sinua: mikä on elävien olentojen kemiallinen koostumus?Koska kodonia on 64 ja proteiinien rakentamisessa käytetään vain 20 aminohappoa, kukin aminohappo voidaan koodata useammalla kuin yhdellä kodonilla. Lähes kaikki elävät olennot käyttävät samoja kodoneja samojen aminohappojen koodaamiseen. Siksi geneettistä koodia pidetään melkein universaalina kielenä.
Tässä koodissa on kodoneja, joita käytetään aloittamiseen ja myös polypeptidin translaation aloittamiseen. Valmistumiskodonit eivät koodaa aminohappoa, vaan pysäyttävät käännöksen ketjun C-terminaaliin, ja niitä edustaa UAA-, UAG- ja UGA-triplettejä.
Toisaalta AUG -kodoni toimii normaalisti aloitussignaalina ja koodaa myös metioniinia.
Translaation jälkeen proteiinit voivat kärsiä jonkin verran prosessointia tai modifiointia, kuten lyhyt miestä, sen lopullisen kokoonpanon saavuttamiseksi.
Viitteet
- C.K -k -. Mathews, k.JA. Pakettiauto Hold & k.G. Ahne. 2002. Biokemia. 3th Painos. Benjamin / Cummings Publishing Company, Inc.
- Murray, P. Mayes, D.C. Granner & V.W -. Rodwell. 1996. Harperin biokemia. Appleton & Lange
- J -.M. Berg, J.Lens. Tymoczko & l. Stryer (SF). Biokemia. 5th Painos. W -. H. Freeman ja yritys.
- J -. Koolman & K.-H. Roehm (2005). Biokemian väri. 2Nd Painos. Thieme.
- -Lla. Lehninger (1978). Biokemia. Omega Editions, S.-Lla.
- Lens. Stryer (1995). Biokemia. W -.H. Freeman and Company, New York.
- « Avogadro -numerohistoria, yksiköt, miten se lasketaan, käyttää
- Eksonukleaasiominaisuudet, rakenne ja toiminnot »

