Rutherfordin kokeiluhistoria, kuvaus ja päätelmät
- 2604
- 638
- Dr. Travis Reichert
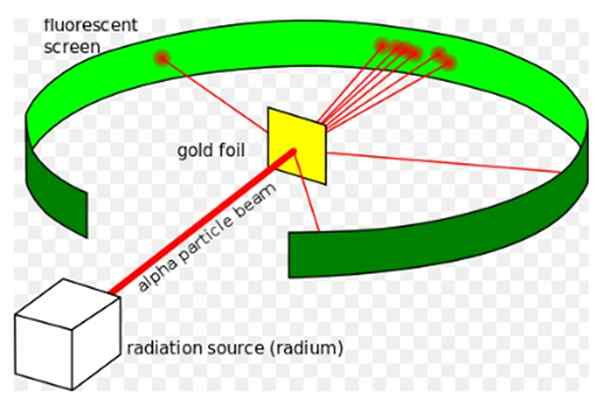
Hän Rutherford -koe, Vuosina 1908–1913, se koostui, että pommitettiin ohut kultalevy, joka oli 0.0004 mm paksu, alfahiukkasten kanssa ja analysoi dispersiokuvio, jonka nämä hiukkaset jäivät fluoresoivaan seulaan.
Itse asiassa Rutherford teki lukuisia kokeita, tarkentamalla yksityiskohtia yhä enemmän. Tulosten analysoinnin jälkeen paljastettiin kaksi erittäin tärkeää johtopäätöstä:
-Atomin positiivinen kuorma on keskittynyt alueelle, jota kutsutaan ydin.
-Tämä atomiydin on uskomattoman pieni verrattuna atomin kokoon.
 Kuvio 1. Rutherfordin kokeilu. Lähde: Wikimedia Commons. Kurzon [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Kuvio 1. Rutherfordin kokeilu. Lähde: Wikimedia Commons. Kurzon [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Ernest Rutherford (1871-1937) oli Uudessa-Seelannissa syntynyt fyysikko, jonka kiinnostava ala oli radioaktiivisuus ja aineen luonne. Radioaktiivisuus oli äskettäinen ilmiö, kun Rutherford aloitti kokeilunsa, Henri Becquerel oli löytänyt sen vuonna 1896.
Vuonna 1907 Rutherford muutti Manchesterin yliopistoon Englannissa tutkimaan atomin rakennetta käyttämällä näitä alfahiukkasia koettimina tällaisen pienen rakenteen sisätilojen tutkimiseksi. Fyysikot Hans Geiger ja Ernest Marsden seurasivat häntä tehtävässä.
He toivoivat nähdä, kuinka alfahiukkas, joka on kaksinkertainen ionisoitu helium -atomi, oli vuorovaikutuksessa ainutlaatuisen kultatomin kanssa varmistaakseen, että kaikki sen kokeneet poikkeamat johtuivat vain sähkövoimasta.
Suurin osa alfahiukkasista ylitti kuitenkin kultalevyn vain pienen poikkeaman.
Tämä tosiasia oli täysin sopusoinnussa Thomsonin atomimallin kanssa, tutkijoiden yllätykseksi pieni prosenttiosuus alfahiukkasista kokenut melko merkittävän poikkeaman.

Ja vielä pienempi prosenttiosuus hiukkasista palasi, pomppimalla kokonaan taaksepäin. Miksi nämä odottamattomat tulokset olivat?
[TOC]
Kokeen kuvaus ja päätelmät
Itse asiassa alfahiukkaset, joita Rutherford käytti koettimena, ovat helium -ytimiä, ja tuolloin tiedettiin vain, että näillä hiukkasilla oli positiivinen varaus. Nykyään tiedetään, että alfahiukkaset koostuvat kahdesta protonista ja kahdesta neutronista.
Rutherford oli tunnistanut Alfa- ja beetapartikkeleita kahtena erityyppisinä säteilyssä uraanista. Alfa -hiukkaset, jotka ovat paljon massiivisempia kuin elektronit, on positiivinen sähkövaraus, kun taas beetapartikkelit voivat olla elektroneja tai positroneja.
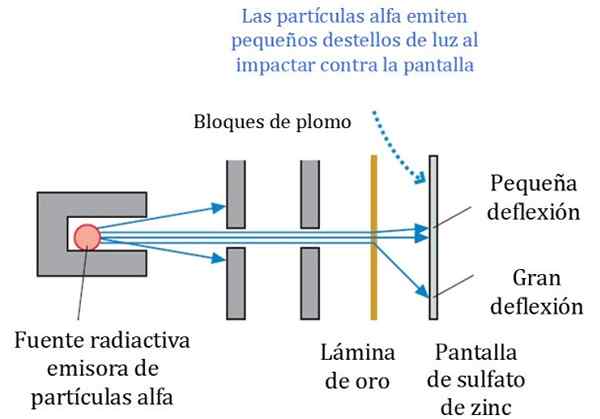 Kuva 2. Rutherfordin, Geigerin ja Marsden -kokeilun yksityiskohtainen kaavio. Lähde: r. Ritari. Tutkijoiden fysiikka ja tekniikka: strategialähestymistapa. Pearson.
Kuva 2. Rutherfordin, Geigerin ja Marsden -kokeilun yksityiskohtainen kaavio. Lähde: r. Ritari. Tutkijoiden fysiikka ja tekniikka: strategialähestymistapa. Pearson. Kuvio 2 esittää kokeilun yksinkertaistetun kaavion. Alfa -hiukkaspalkki tulee radioaktiivisesta lähteestä. Geiger ja Marsden käyttivät radonikaasua emitterinä.
Lyijypalikoita käytettiin säteilyn ohjaamiseen kultalevyyn ja estämään niitä pysähtymästä suoraan fluoresoivaan näytökseen. Lyijy on materiaali, joka absorboi säteilyä.
Voi palvella sinua: Centrioles: toiminnot ja ominaisuudetSitten suunnattu palkki vaikutti siten ohuen kultalevyyn ja suurin osa hiukkasista seuraa tiensä fluoresoivaan sinkkisulfaattiseulaan, jossa he jättivät pienen kevyen jalanjäljen. Geiger vastasi niiden laskemisesta yksi kerrallaan, vaikka he sitten suunnittelivat laitteen, joka teki sen.
Se tosiasia, että jotkut hiukkaset kokenut pienen taipuman, ei yllättänyt Rutherfordia, Geigeriä ja Marsden. Loppujen lopuksi, atomisessa on positiivisia ja negatiivisia varauksia, joilla on lujuus alfahiukkaille, mutta koska atomi on neutraali, jonka he jo tiesivät, poikkeamien tulisi olla pieniä.
Kokeen yllätys on, että muutama positiivinen hiukkas.
Päätelmät
Noin yksi 8000 alfahiukkasesta kokenut taipumat yli 90º: n kulmissa. Harvat, mutta tarpeeksi kyseenalaistaa joitain asioita.
Bogan atomimalli oli Thomsonin Pudin, entinen Rutherfordin professori Cavendishin laboratoriossa, mutta hän ihmetteli, onko ajatus atomista ilman ytimtä ja rusinoita upotettujen elektronien kanssa, se oli oikein.
Koska osoittautuu, että nämä alfahiukkasten suuri taipuma ja se, että muutama kykenee palaamaan, se voidaan selittää vain, jos atomilla on pieni, raskas ja positiivinen ydin. Rutherford oletti, että vain sähköisen vetovoiman ja torjumisen voimat, kuten Coulombin laki osoittaa, olivat vastuussa poikkeamista.
Kun jotkut alfahiukkasista lähestyvät suoraan ytimeen ja koska sähkövoima vaihtelee etäisyyden käänteisen neliön mukaan, he tuntevat torjumisen, joka aiheuttaa heille suuren kulman dispersion tai poikkeaman taaksepäin.
Varmistamiseksi, että Geiger ja Marsden kokenut eri metallien pommituslevyt, ei vain kultaa, vaikka tämä metalli oli sopivin heidän muokattavuuteensa, luodakseen erittäin hienoja arkkeja.
Saatuaan samanlaisia tuloksia, Rutherford vakuutti, että atomin positiivisen kuorman tulisi sijaita ytimessä eikä sitä ole hajautettu sen koko tilavuuteen, kuten Thomson posteeroitui mallissaan.
Toisaalta, kuten suurin osa alfahiukkasista, se tapahtui ilman poikkeavia, ytimen tulisi olla hyvin, hyvin pieni verrattuna atomiskokoon. Tämän ytimen oli kuitenkin keskitettävä suurimman osan atomin massasta.
Vaikutteet atomimallissa
Tulokset olivat erittäin yllättyneitä Rutherfordista, joka julisti Cambridgen konferenssissa: ”… Se on kuin kun amput 15 -tuumaisen tykin luodin silkkipaperia vasten ja ammus pomppii suoraan sinulle ja osuu sinuun".
Voi palvella sinua: 10 tutkimuksen teoreettisen kehyksen toimintoaKoska näitä tuloksia ei voitu selittää Thomsonin atomimallilla, Rutherford ehdotti, että atomi muodostettiin ytimellä, erittäin pieni, erittäin massiivinen ja positiivisesti ladattu. Elektronit kuvaavat edelleen kiertoratoja heidän ympärillään, mikä aurinkoeneraturijärjestelmä.
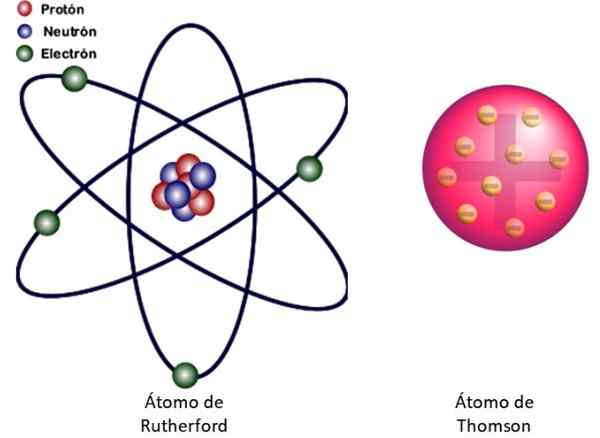 Kuva 3. Vasemmalla Rutherfordin atomimalli ja oikealla puolella Thomsonin Buddin -tyyppimalli. Lähde: Wikimedia Commons. Vasen kuva: Jcymc90 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
Kuva 3. Vasemmalla Rutherfordin atomimalli ja oikealla puolella Thomsonin Buddin -tyyppimalli. Lähde: Wikimedia Commons. Vasen kuva: Jcymc90 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Tämä on kuviossa 3 esitetty atomin ydinmalli vasemmalle. Koska elektronit ovat myös hyvin, hyvin pieniä, osoittautuu, että atomi on melkein kaikki .. . tyhjä! Siksi suurin osa alfahiukkasista ylittää arkin poikkeamatta vain.
Ja analogia miniatyyri aurinkojärjestelmän kanssa on erittäin onnistunut. Atomi -ytimellä on auringon rooli, joka sisältää melkein koko massan plus positiivinen kuorma. Elektronit kiertävät heidän ympärillään, kuten planeetat ja kantavat negatiivista kuormaa. Sarja on sähköisesti neutraali.
Elektronien jakautumisesta atomiin Rutherfordin kokeilu ei osoittanut mitään. Voitaisiin ajatella, että alfahiukkasilla olisi jonkin verran vuorovaikutusta niiden kanssa, mutta elektronien massa on liian pieni eikä pystynyt merkittävästi ohjaamaan hiukkasia merkittävästi.
Haitat Rutherford -mallissa
Tämän atomimallin ongelma oli juuri elektronien käyttäytyminen.
Jos nämä eivät olisi staattisia, mutta kiertävät atomiydin ympyrä- tai elliptisissä kiertoraissa, joita ohjataan sähköverkosta, ne päätyvät kiirehtimään ytimeen.
Tämä johtuu siitä, että kiihdytetyt elektronit menettävät energiaa, ja jos niin tapahtuu, se olisi atomin ja aineen romahtaminen.
Onneksi tämä ei ole mitä tapahtuu. On olemassa eräänlainen dynaaminen stabiilisuus, joka välttää romahduksen. Seuraava atomimalli, Rutherfordin jälkeen, oli Bohr, joka antoi joitain vastauksia siihen, miksi atomien romahtaminen ei tapahdu.
Protoni ja neutroni
Rutherford jatkoi dispersiokokeiden tekemistä. Vuosina 1917–1918 hän ja hänen avustajansa William Kay päättivät pommittaa.
Se oli jälleen yllättynyt, kun havaittiin vetyydiniä. Tämä on reaktioyhtälö, ensimmäinen keinotekoinen ydinmuutosta ei koskaan saavutettu:
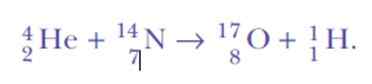 No, jos alfahiukkaset ovat helium -ytimiä, mistä vedyn ytimet voivat tulla?
No, jos alfahiukkaset ovat helium -ytimiä, mistä vedyn ytimet voivat tulla?
Vastaus oli: samasta typestä. Rutherford oli osoitettu vetyatomille numerolle 1, koska se oli kaikkien yksinkertaisin elementti: positiivinen ydin ja negatiivinen elektroni.
Rutherford oli löytänyt perustavanlaatuisen hiukkasen, jonka hän kutsui protoni, nimi, joka on johdettu kreikkalaisesta sanasta ensimmäinen. Tällä tavoin protoni on jokaisen atomien ytimen olennainen aineosa.
Voi palvella sinua: tilavuusMyöhemmin, vuoteen 1920 mennessä, Rutherford ehdotti, että siellä tulisi olla neutraali hiukkas ja massa, joka on hyvin samanlainen kuin protonin. Hän kutsui tätä hiukkasia neutroni ja on osa melkein kaikkia tunnettuja atomeja. Fyysikko James Chadwick tunnisti sen lopulta vuonna 1932.
Kuinka vetyatomin mittakaavamalli on?
Vetyatomi on, kuten olemme sanoneet, yksinkertaisin kaikista. Tälle atomille ei kuitenkaan ollut helppoa kehittää mallin.
Peräkkäiset löytöt aiheuttivat kvanttifysiikan ja kokonaisen teorian, joka kuvaa atomitason ilmiöitä. Tämän prosessin aikana myös atomimalli kehittyi. Mutta katsotaanpa koon kysymys vähän:
Vetyatomilla on ydin, joka koostuu protonista (positiivinen), ja siinä on yksi elektroni (negatiivinen).
Vetyatomin säde on arvioitu 2.1 x 10-10 m, vaikka protoni on 0.85 x 10 -viisitoista m tai 0.85 femtometrit. Tämän pienen yksikön nimi johtuu Enrico Fermistä, ja sitä käytetään paljon työskennellessään tällä asteikolla.
No, atomin ja ytimen säteen välinen osuus on luokkaa 105 M, toisin sanoen atomi on 100 000 kertaa suurempi kuin ydin!.
Meidän on kuitenkin pidettävä mielessä, että kvanttimekaniikkaan perustuvassa nykyaikaisessa mallissa elektroni sisältää ytimen eräänlaisessa pilvessä nimeltään orbitaali- (kiertorata ei ole kiertorata), ja elektroni ei ole täsmällinen.
Jos vetyatomi laajennetaan laajasti - jalkapallokentän kokoon, niin positiivisesta protonista koostuva ydin olisi muurahaisen koko kentän keskellä, kun taas negatiivinen elektroni olisi kuin eräänlainen aave, hajallaan koko kentällä ja ympäröivää positiivista ydintä.
Atomimalli tänään
Tämä "planeetta" atomimalli on hyvin juurtunut ja on kuva, joka useimmilla ihmisillä on atomista, koska se on erittäin helppo visualisoida. kuitenkin, se ei ole Malli hyväksytty tänään tieteellisellä alalla.
Nykyaikaiset atomimallit perustuvat kvanttimekaniikkaan. Hän huomauttaa, että atomin elektroni ei ole pieni piste negatiivisella kuormalla, joka seuraa tarkkoja kiertoratoja, kuten Rutherfordin kuvitellut.
Päinvastoin, elektroni on hajallaan Alueilla, nimeltään positiivisen ytimen ympärillä atomi -orbitaalit. Häneltä voimme tietää todennäköisyys tavata yhdessä tai toisessa.
Tästä huolimatta Rutherford -malli tarkoitti valtavaa edistystä atomin sisäisen rakenteen tuntemuksessa. Ja he ratsastivat tietä useammalle tutkijoille jatkaa sen parantamista.
Viitteet
- Andriessen, M. 2001. HSC -kurssi. Fysiikka 2. Jacaranda HSC Science.
- Arfken, G. 1984. Yliopistofysiikka. Akateeminen lehdistö.
- Ritari, r. 2017. Tutkijoiden fysiikka ja tekniikka: strategialähestymistapa. Pearson.
- Fysiikka OpenLab. Rutherford-Geiger-Marsden-kokeilu. Toipunut: Physicsopenlab.org.
- Rex, a. 2011. Fysiikan perusteet. Pearson.
- Tyson, t. 2013. Rutherfordin sirontakoe. Toipunut: 122.Fysiikka.Ucdavis.Edu.
- Xaktly. Rutherfordin kokeet. Toipunut: Xaktly.com.
- Wikipedia. Rutherford -koe. Palautettu: se on.Wikipedia.org.
- « Autotrophin ravitsemusominaisuudet, vaiheet, tyypit, esimerkit
- Anna Freudin elämäkerta, teoriat, puolustusmekanismit, teokset »

