Kalsiumfluoridi (CAF2) rakenne, ominaisuudet, käytöt

- 4185
- 1279
- Alonzo Kirlin
Hän kalsiumfluori Se on epäorgaaninen kiinteä aine, joka on muodostettu kalsiumiatomilla (CA) ja kahdella fluoriatomilla (F). Sen kemiallinen kaava on CAF2 Ja se on kiteinen harmaa -valkoinen kiinteä kiinteä.
Luonnossa sitä löytyy fluorimalmista tai roiske fluorista. Se on luonnollisesti luissa ja hampaissa. Fluoriitti mineraali on päälähde, jota käytetään muiden fluoriyhdisteiden saamiseen.
 CAF -kalsiumfluori2 kiinteä. W: Käyttäjä: Walkerma kesäkuussa 2005. Lähde: Wikimedia Commons.
CAF -kalsiumfluori2 kiinteä. W: Käyttäjä: Walkerma kesäkuussa 2005. Lähde: Wikimedia Commons. Lisäksi kahvi2 Sitä käytetään hampaiden karies -ehkäisyyn, joten hammaslääkärit käyttävät materiaaleja parantamaan niitä. Itse asiassa kalsiumfluoridia lisätään myös juomaveteen (vesi, joka voi olla humalassa) siten, että populaatio hyötyy hampaiden nauttimisessa ja harjaamisessa.
Kahvila2 Sitä käytetään suurissa kiteissä optisissa laitteissa ja kameroissa. Sitä käytetään myös pienissä laitteissa, jotka tunnistavat kuinka paljon henkilö on altistunut radioaktiivisuudelle.
[TOC]
Rakenne
CAF -kalsiumfluori2 Se on ioninen yhdiste, jonka muodostuu CA -kalsiumkationista2+ ja kaksi fluori -fluoria-. Jotkut tietolähteet osoittavat kuitenkin, että niiden linkillä on tietty kovalenttinen merkki.
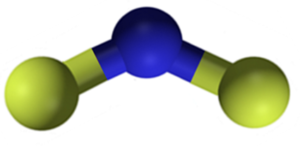 CAF -kalsiumfluoridirakenne2. Sininen: kalsium; Keltainen fluori. Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons.
CAF -kalsiumfluoridirakenne2. Sininen: kalsium; Keltainen fluori. Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons. Nimikkeistö
Kalsiumfluori
Ominaisuudet
Fyysinen tila
Kiinteä tai harmahtava valkoinen värillinen kiteinen rakenne.
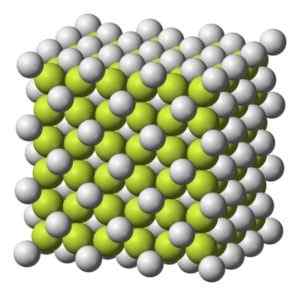 Kahvin kuutiomettinen kiteinen rakenne2. Benjah-BMM27 [julkinen alue]. Lähde: Wikimedia Commons.
Kahvin kuutiomettinen kiteinen rakenne2. Benjah-BMM27 [julkinen alue]. Lähde: Wikimedia Commons. Molekyylipaino
78,07 g/mol
Sulamispiste
1418 ºC
Kiehumispiste
2533 ºC
Tiheys
3,18 g/cm3 20 ° C: ssa.
Taitekerroin
1 4328
Liukoisuus
Se on liukenematon veteen 20 ° C: ssa. Lähes liukenematon lämpötilassa 25 ° C: 0,002 g/100 ml vettä. Liukeneva liukeneva.
Kemialliset ominaisuudet
Sen hapettavat tai pelkistävät ominaisuudet ovat erittäin heikkoja, mutta nämä reaktiot voivat tapahtua. Vaikka yleensä hyvin harvoissa tapauksissa.
Se on inertti orgaanisiin kemiallisiin yhdisteisiin ja moniin happoihin, mukaan lukien HF -fluoriahappo. Se liukenee hitaasti typpihapoon3.
Voi palvella sinua: Millikan -kokeilu: Menettely, selitys, merkitysSe ei ole syttyvä. Ei reagoi nopeasti ilman tai veden kanssa.
Veden pienen affiniteetin vuoksi, vaikka se altistuu suurelle kosteusprosentille, se ei vaikuta siihen edes kuukauden ajan normaalissa huoneenlämpötilassa.
Kosteuden läsnä ollessa niiden kiteiden seinät liuotetaan hitaasti yli 600 ° C: n lämpötiloihin. Kuivissa ympäristöissä sitä voidaan käyttää jopa noin 1000 ° C: seen ilman huomattavasti vaikutusta.
Läsnäolo luonnossa
CAF -kalsiumfluori2 Sitä löytyy luonnollisesti fluorimalmista tai roiske fluoridista.
Vaikka kahvi2 Puhdas on väritöntä, fluoriitti mineraali värittää usein kiteisen rakenteen "reikiin" loukkuun jääneiden elektronien läsnäololla.
Tätä mineraalia on erittäin arvostettu sen lasimaisesta kirkkaudesta ja väreistä (violetti, sininen, vihreä, keltainen, väritön, ruskea, vaaleanpunainen, musta ja punertavan oranssi). Sen sanotaan olevan "maailman värillisin mineraali".
 Kaivoksen fluorite Ranskassa. Toulouse Muséum [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons.
Kaivoksen fluorite Ranskassa. Toulouse Muséum [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons. Milanon luonnonmuseon fluoriitti (siniset kiteet). Giovanni Dall'orto [cc by-Sa 2.5 IT (https: // creativecommons.Org/lisenssit/by-SA/2.5/IT/teko.sisään)]. Lähde: Wikimedia Commons.
Milanon luonnonmuseon fluoriitti (siniset kiteet). Giovanni Dall'orto [cc by-Sa 2.5 IT (https: // creativecommons.Org/lisenssit/by-SA/2.5/IT/teko.sisään)]. Lähde: Wikimedia Commons. Kaivoksen fluorite Englannissa. Didier Descuens [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons.
Kaivoksen fluorite Englannissa. Didier Descuens [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons. Kaivoksen fluorite Ranskassa. Didier Descuens [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons.
Kaivoksen fluorite Ranskassa. Didier Descuens [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons.
 Kaivoksen fluorite Yhdysvalloissa. Kirjoittaja: Oliveira Jurema. Lähde: Wikimedia Commons.
Kaivoksen fluorite Yhdysvalloissa. Kirjoittaja: Oliveira Jurema. Lähde: Wikimedia Commons. Kalsiumfluoridia löytyy myös luiden määristä välillä 0,2-0,65%ja myös hampaiden emalissa 0,33-0,59%.
Sovellukset
- Fluoriyhdisteiden saamiseksi
Fluorita2 Se on fluoridin perus- tai enemmistölähde maailmanlaajuisesti. Raaka -aine on melkein kaikkien fluoriyhdisteiden valmistelu.
Tärkein näistä on HF -fluoriarhorihappo, josta muut fluoroituja yhdisteitä valmistetaan. Fluori -ioni f- Se vapautuu mineraalista tämän reaktiolla konsentroituneella rikkihapolla H2Sw4-
Voi palvella sinua: isomeriaKahvila2 (kiinteä) + h2Sw4 (nestemäinen) → tapaus4 (kiinteä) + 2 HF (kaasu)
- Hampaiden hoidossa
CAF -kalsiumfluori2 Se on karies -ehkäisyn agentti. Sitä käytetään fluoroimaan juomavedet (vedet, jotka voivat olla juomia) tällä tavoitteella.
Lisäksi alhaiset fluoridipitoisuudet f- (luokkaa 0,1 miljoonaa osaa), joita käytetään dentifric -pasteissa ja suuvedet ovat osoittaneet olevan syvä positiivinen vaikutus karieksen ennaltaehkäisevään hampaanhoitoon.
 Kalsiumfluori auttaa karieksen ehkäisyssä. Kirjoittaja: Annalize Batista. Lähde: Pixabay.
Kalsiumfluori auttaa karieksen ehkäisyssä. Kirjoittaja: Annalize Batista. Lähde: Pixabay. Caf -nanohiukkaset2 tehokkaampi
Vaikka fluorideja käytetään hammaspastauksissa ja huuhtelussa, syljen alhainen kalsiumpitoisuus (CA) aiheuttaa kahvia kerrostumat, joita ei muodostua2 hampaissa tehokkaimmalla mahdollisella tavalla.
Siksi tapa saada kahvipölyä on suunniteltu2 nanohiukkasina.
Tätä varten Rocío käyttää kuivausrumpua (englannista Sumutuskuivaus) Missä kaksi liuosta (yksi Ca (OH) -kalsiumhydroksidista2 ja yksi ammoniumfluoridista NH4F) ne sekoittuvat, kun ne ruiskutetaan kameraan kuumalla ilmavirralla.
Sitten seuraava reaktio tapahtuu:
CA (OH)2 + Nh4F → CAF2 (kiinteä) + NH4vai niin
NH4Voi haihtuminen nimellä NH3 ja h2O ja CAF -nanohiukkaset ovat jäljellä2.
Näillä on korkea reaktiivisuus ja suurempi liukoisuus, mikä tekee niistä tehokkaampia hampaiden seineralisoinnissa ja vastakohdina.
- Linssissä optisille laitteille
Kalsiumfluoridia käytetään optisten elementtien, kuten infrapuna- ja ultraviolettivalon (UV) spektrofotometrien, rakentamiseen, kuten prismat ja spektrofotometrien.
Nämä laitteet mahdollistavat materiaalin absorboiman valon määrän mittaamisen sen läpi.
Kahvila2 Se on läpinäkyvä näillä valon spektrin alueilla, sillä on erittäin alhainen taitekerroin ja se mahdollistaa tehokkaamman resoluution saamisen kuin NaCl: n väliaikalla 1500-4000 cm-1.
Voi palvella sinua: paramagnetismiKemiallisen stabiilisuuden ansiosta voi tukea haitallisia olosuhteita siten, että CAF: n optiset elementit2 Heitä ei hyökätä. Sillä on myös suuri kovuus.
Kameroissa
Jotkut kameranvalmistajat käyttävät kahvilinssejä2 keinotekoinen kiteytetty valon dispersion vähentämiseksi ja värien vääristymisen erinomaisen korjaamiseksi.
 Joillakin kameroilla on CAF -kalsiumfluori -linssit2 Värien vääristymisen vähentämiseksi. Bill Ebbesen [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)]. Lähde: Wikimedia Commons.
Joillakin kameroilla on CAF -kalsiumfluori -linssit2 Värien vääristymisen vähentämiseksi. Bill Ebbesen [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)]. Lähde: Wikimedia Commons. - Metallurgisessa teollisuudessa
Kahvila2 Sitä käytetään perustaja -aineena metallurgisessa teollisuudessa, koska se on kalsiumin lähde liukenemattomaksi veteen ja siksi tehokas happea -herkät sovellukset.
Sitä käytetään raudan ja teräksen sulamiseen ja käsittelemiseen. Tämä perustuu siihen tosiasiaan, että sen sulamispiste on samanlainen kuin raudan ja myös se, että se voi liuottaa oksidit ja metallit.
- Radioaktiivisuuden ilmaisimissa tai vaarallisessa säteilyssä
Kahvila2 Se on termoluminesoiva materiaali. Tämä tarkoittaa, että se voi absorboida säteilyä kiteisen rakenteen elektroneissa ja sitten kun sitä lämmitetään sen vapauttamiseksi valon muodossa.
Tämä emittoitu valo voidaan mitata sähköisellä signaalilla. Tämä signaali on verrannollinen materiaalin vastaanottaman säteilyn määrään. Tarkoittaa, että mitä suurempi säteilyn määrä on, sitä suurempi valon määrä, joka lähetetään myöhemmin kuumennettaessa.
Siksi CAF2 Sitä käytetään niin kutsutuissa henkilökohtaisissa kahdessa nimessä.
- Muut käyttötarkoitukset
- Sitä käytetään katalysaattorina dehydraation ja dehydrauksen kemiallisissa reaktioissa orgaanisten yhdisteiden synteesiä varten.
- Sitä käytetään hitsauksen emäksissä. Saadaan vahvempi hitsaus kuin happoelektrodeilla. Nämä elektrodit ovat hyödyllisiä alusten ja korkeapaineisen teräsastian valmistuksessa.
- Elintarvikealisäosana erittäin pieninä määrinä (ppm tai osa miljoonaan).
 Mieshitsaus. Elektrodit, joissa on kalsiumfluoridikahvi2 Ne muodostavat vahvempia hitsauksia. William M. Levy JR. [Julkinen verkkotunnus]. Lähde: Wikimedia Commons.
Mieshitsaus. Elektrodit, joissa on kalsiumfluoridikahvi2 Ne muodostavat vahvempia hitsauksia. William M. Levy JR. [Julkinen verkkotunnus]. Lähde: Wikimedia Commons. Viitteet
- Pirmradian, m. ja hooshmand, t. (2019). Hartsipohjaisten hammasnanokomposiittien remineralisaatio ja antibakteeriset kyvyt. Kalsiumfluoridin synteesi ja karakterisointi (CAF2-A. Nanokomposiittimateriaalien sovelluksissa hammaslääketieteessä. ScienEdirect.com.
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Fluoridikalsium. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Weman, k. (2012). Metallikaari -manuaalinen (MMA) hitsaus päällystetyillä elektrodeilla. Hitsausprosesseissa käsikirja (toinen painos). ScienEdirect.com.
- Hanning, m. ja Hanning, c. (2013). Nanobiomateriaalit ennaltaehkäisevässä hammaslääketieteessä. Nanosoitu fluori kalsium. Nanobiomateriaalissa kliinisessä hammaslääketieteessä. ScienEdirect.com.
- Ropp, r.C. (2013). Ryhmä 17 (H, F, CL, BR, I) Elämälaatikkoyhdisteet. Fluoridikalsium. Alkalisten maapallon yhdisteiden tietosanakirjassa. ScienEdirect.com.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Valkovic, v. (2000). Radioaktiivisuuden mittaukset. Radioaktiivisuudessa ympäristössä. Themoluminescent -ilmaisimet (TLD). ScienEdirect.com.
- « Nitruro de Boro (BN) -rakenne, ominaisuudet, hankkiminen, käyttö
- Pihioksidirakenne (SIO2), ominaisuudet, käyttää, saada »

