Pihioksidirakenne (SIO2), ominaisuudet, käyttää, saada

- 4780
- 816
- Gustavo Runte DVM
Hän piihioksidi Se on epäorgaaninen aine. Sen kemiallinen kaava on silloin2. Tätä luonnollista yhdistettä kutsutaan myös piisiksi tai piisidioksidiksi.
SIO2 Se on maankuoren runsain mineraali, koska hiekka koostuu piidioksidista. Rakenteensa mukaan piidioksidi voi olla kiteinen tai amorfinen. Se on liukenematon veteen, mutta liukenee alkaliin ja fluoriahappoon HF.
 Hiekka on silikonidioksidisio -lähde2. ರವಿಮುಂ [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons.
Hiekka on silikonidioksidisio -lähde2. ರವಿಮುಂ [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons. SIO2 Sitä esiintyy myös tiettyjen kasvien, bakteerien ja sienten rakenteessa. Myös meriorganismien luurankoissa. Hiekan lisäksi on myös muun tyyppisiä kiviä, jotka ovat piidioksidia.
Piidioksidilla on erittäin laaja käyttö, joka täyttää erilaisia toimintoja. Yleisin käyttö on nesteiden, kuten öljyjen ja öljytuotteiden, juomien, kuten oluen ja viinin, suodatusmateriaalia sekä hedelmämehuja.
Mutta siinä on monia muita sovelluksia. Yksi hyödyllisimmistä ja tärkeimmistä on bioaktiivisen lasin valmistuksessa, joka mahdollistaa ”telineet”, joissa luusolut kasvavat tuottamaan puuttuvia luun osia onnettomuuden tai sairauden takia.
[TOC]
Rakenne
Piilakuljetus2 Se on kolmen atomin molekyyli, jossa piidiatomi on kytketty kahteen happiatomiin, joissa on kovalenttisia sidoksia.
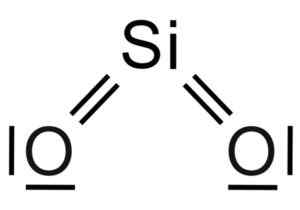 SIO -molekyylin kemiallinen rakenne2. Grasso Luigi [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons.
SIO -molekyylin kemiallinen rakenne2. Grasso Luigi [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons. Kiinteän piidioksidin rakenneyksikkö sellaisenaan on tetraedri, jossa piidiatomia ympäröi 4 happiatomia.
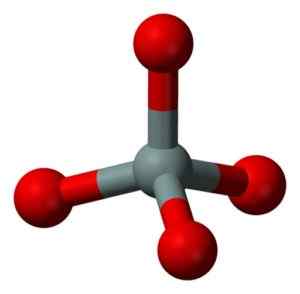 Kiinteän piidioksidin rakenneyksikkö: harmaa = pii, punainen = happi. Benjah-BMM27 [julkinen alue]. Lähde: Wikimedia Commons.
Kiinteän piidioksidin rakenneyksikkö: harmaa = pii, punainen = happi. Benjah-BMM27 [julkinen alue]. Lähde: Wikimedia Commons. Tetrahedra sitoutuu toisiinsa jakamalla vierekkäisten kärkipisteiden happiatomeja.
Siksi piidiatomilla on puolessa kutakin neljää happiatomia ja tämä selittää yhden piin atomin yhdisteen suhteessa 2 happiatomissa (SiO2-A.
 Tetrahedra jakaa happea SiO: ssa2. Benjah-BMM27 [julkinen alue]. Lähde: Wikimedia Commons.
Tetrahedra jakaa happea SiO: ssa2. Benjah-BMM27 [julkinen alue]. Lähde: Wikimedia Commons. SIO -yhdisteet2 Ne on jaettu kahteen ryhmään: kiteinen piidioksidi ja amorfinen piidioksidi.
Kiteinen piidioksidiyhdisteillä on rakenteita, joissa on toistuvia pii- ja happikuvioita.
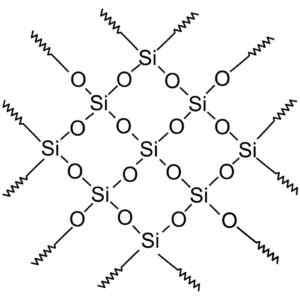 Kiteisessä piidioksidissa on toistuvia yksiköitä. Wersję Rastrową Wykonał Użytkownik Polskiego Projektu wikipediii: Polyimerek, Zwektoryzował: Krzysztof Zajączkowski [gfdl (http: // www.GNU.Org/copyleft/fdl.HTML)]. Lähde: Wikimedia Commons.
Kiteisessä piidioksidissa on toistuvia yksiköitä. Wersję Rastrową Wykonał Użytkownik Polskiego Projektu wikipediii: Polyimerek, Zwektoryzował: Krzysztof Zajączkowski [gfdl (http: // www.GNU.Org/copyleft/fdl.HTML)]. Lähde: Wikimedia Commons. Kaikkia piidioksidikiteitä voidaan pitää jättiläismolekyylinä, jossa kiteinen verkko on erittäin vahva. Tetrahedra voidaan yhdistää eri tavoin, mikä aiheuttaa erilaisia kiteisiä muotoja.
Voi palvella sinua: Bravais Networks: Konsepti, ominaisuudet, esimerkit, harjoituksetAmorfisessa piidioksidissa rakenteet ovat satunnaisesti kytkettyjä seuraamatta säännöllistä mallia molekyylien välillä, ja nämä ovat eri alueellisessa suhteessa toistensa kanssa toistensa kanssa.
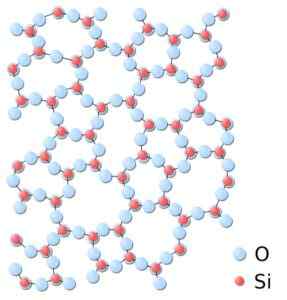 Amorfisessa piidioksidissa ammattiliitot eivät ole toistuvia tai yhtenäisiä. Piidioksidi.SVG: *piidioksidi.JPG: IN: Käyttäjä: JdrewittDerivepative Work: Matt [julkinen verkkotunnus]. Lähde: Wikimedia Commons.
Amorfisessa piidioksidissa ammattiliitot eivät ole toistuvia tai yhtenäisiä. Piidioksidi.SVG: *piidioksidi.JPG: IN: Käyttäjä: JdrewittDerivepative Work: Matt [julkinen verkkotunnus]. Lähde: Wikimedia Commons. Nimikkeistö
-Piihioksidi
-Piidioksidi
-Piidioksidi
-Kvartsi
-Tridimita
-Cristobalita
-Dioksosilano
Ominaisuudet
Fyysinen tila
Väritön väritön harmaa.
 Siivous2 puhdas. LHCHEM [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons.
Siivous2 puhdas. LHCHEM [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons. Molekyylipaino
60 084 g/mol
Sulamispiste
1713 ºC
Kiehumispiste
2230 ºC
Tiheys
2,17-2,32 g/cm3
Liukoisuus
Liukenematon veteen. Amorfinen piidioksidi liukoinen alkalissa, varsinkin jos se on hienosti jaettu. Liukoinen fluorhorhorihapon HF.
Amorfinen piidioksidi on vähemmän hydrofiilinen, toisin sanoen vähemmän liittyvä veteen kuin kiteinen.
Kemialliset ominaisuudet
SIO2 o piidioksidi on pääosin inertti useimpiin aineisiin, se on hyvin vähän reaktiivista.
Kloorin Cl: n hyökkäys vastustaa2, Bromo br2, Vety h2 ja useimmista hapoista huoneenlämpötilassa tai hieman korkeampi. Fluori F hyökkää2, HF -fluoriahappo ja alkalit, kuten natriumkarbonaatti2Yhteistyö3.
SIO2 Se voidaan yhdistää metallielementeihin ja oksideihin silikaattien muodostamiseksi. Jos piidioksidi sulaa alkalisella metallikarbonaatilla noin 1300 ° C: ssa, saadaan alkaliset silikaatit ja CO2.
Se ei ole polttoainetta. Sillä on alhainen lämmönjohtavuus.
Läsnäolo luonnossa
Tärkein piidioksidilähde luonnossa on hiekka.
SIO2 o Piidioksidi on kolmen kiteisen lajin muodossa: kvartsi (stabiili), Tridimita ja Cristobalita. Amorfantti piidioksidille ovat agata, jaspe ja Ónice. Opaali on amorfinen hydratoitu piidioksidi.
Siellä on myös niin kutsuttu biogeeninen piidioksidi, toisin sanoen elävien organismien tuottama. Tämän tyyppisen piidioksidin lähteet ovat bakteerit, sienet, piimat, merisienet ja kasvit.
Bambu ja oljen kirkkaat ja kovat osat sisältävät piidioksidia, ja joidenkin meriorganismien luurankoissa on myös suuri osa piidioksidia; Tärkeintä ovat kuitenkin diatomatorit.
Diatomea -maat ovat rappeutuneiden yksisoluisten organismien geologisia tuotteita (leviä).
Voi palvella sinua: kosminen pölyMuun tyyppiset luonnolliset piidioksidit
Luonnossa on myös seuraavia lajikkeita:
- Lasimaiset silikaanit, jotka ovat vulkaanisia lasia
- Milleritas, jotka ovat luonnollista lasia, tuotettua piipitoisen materiaalin fuusiolla meteoriittien vaikutuksesta
- Sulaa piidioksidia, joka lämmitetään piidioksidia nestemäiseen ja jäähdytettyyn faasiin sallimalla kristillinen
Saada
Areenan piidioksidia saadaan suoraan louhoksista.
 Areenan louhokset Kaliforniassa. Ruff tux kermapuff [CC0]. Lähde: Wikimedia Commons.
Areenan louhokset Kaliforniassa. Ruff tux kermapuff [CC0]. Lähde: Wikimedia Commons. Diatomiitti tai piimat saadaan myös tällä tavalla käyttämällä samanlaisia kaivinkoneita ja laitteita.
Amorfinen piidioksidi valmistetaan perustuen vesipitoisiin alkalisen metallisilikaattiliuoksiin (kuten natrium -na) neutraloimalla hapolla, kuten rikkihappo H2Sw4, HCL -suolahappo tai hiilidioksidi2.
Jos liuoksen lopullinen pH on neutraali tai emäksinen, saostettu piidioksidi saadaan. Jos pH on hapan, saadaan geeli piidioksidi.
Pyrogeeninen piidioksidi valmistetaan polttamalla haihtuvaa piiyhdistettä, yleensä pii -sicl -tetrakloridia4. Saostettu piidioksidi saadaan silikaattien vesiliuoksesta, johon happoa lisätään.
Kolloidinen piidioksidi on amorfisen piidioksidi -kolloidisten hiukkasten vakaa dispersio vesiliuoksessa.
Sovellukset
Useissa sovelluksissa
Piidioksidi2 Sillä on laaja valikoima toimintoja, esimerkiksi se toimii hioma-, imukykyisenä, antipelmazantina, täytetyinä, opastamisina ja muiden aineiden keskeyttämisen suosimiseksi monien muiden työllisyysmuotojen joukossa.
Sitä käytetään esimerkiksi:
-Lasi, keraaminen, tulenkestävä, hioma ja liukoinen lasivalmistus
-Öljyjen ja öljytuotteiden värimuutokset ja puhdistaminen
-Valimoiden muotissa
-Kaikenlaisten jauheiden antiapelmazante
-ANTPUMANT
-Nesteiden, kuten kuivien pesujen, uima -altaiden ja kunnallisen ja teollisuuden jäteveden veden suodattamiseksi
-Lämpöeristimien valmistuksessa, palonkestävien tiilien ja palon ja happojen kestävien pakkausmateriaalien valmistuksessa
-Paperien ja korttien valmistuksen täyttämisenä, jotta niistä olisi kestävämpiä
-Täytetty maalauksilla sen virtauksen ja värin parantamiseksi
-Metallin kiillotusta ja puuta koskevissa materiaaleissa
-Kemiallisissa analyysilaboratorioissa kromatografiassa ja absorboivana
-Hyönteismyrkky- ja maatalouskemiallisten kaavojen antiapelmazante, torjunta -aineen jauhamisen ja aktiivisen yhdisteen kantajaksi
-Katalysaattorina
-Täyttämisenä synteettisen kumin ja kumien vahvistamiseksi
Voi palvella sinua: pitkittäiset aallot: ominaisuudet, erot, esimerkit-Eläinruoan nesteiden kantajana
-Painettuna musteilla
-Kuivausaineena ja adsorbenttina, piidiomelin muodossa
-Additiivina semenissä
-Lemmikkihiekkaana
-Mikroelektroniikkaeristimissä
-Termoptisissa kytkimissä
 Silikageeli. Kenpei [cc by-Sa 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/]]. Lähde: Wikimedia Commons.
Silikageeli. Kenpei [cc by-Sa 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/]]. Lähde: Wikimedia Commons. Elintarviketeollisuudessa
Amorfinen piidioksidi sisällytetään moniin elintarvikkeisiin monitoimisena suorana ainesosana erityyppisissä ruokia. Sinun ei pitäisi ylittää 2% valmiista ruoasta.
Esimerkiksi se toimii antipelmazantena (tiettyjen elintarvikkeiden tarttumisen estämiseksi) stabilisaattorina oluen tuotannossa, viinin, oluen ja hedelmämehujen tai vihannesten suodattamiseksi.
 Viininsuodatusjoukkue piimoilla (siimi2-A. Fabio Ingroso [CC 2: lla.0 (https: // creativecommons.Org/lisenssit/by/2.0)]. Lähde: Wikimedia Commons.
Viininsuodatusjoukkue piimoilla (siimi2-A. Fabio Ingroso [CC 2: lla.0 (https: // creativecommons.Org/lisenssit/by/2.0)]. Lähde: Wikimedia Commons. Se toimii nestemäisenä imukykyisenä joissakin mikrokapselien elintarvikkeissa ja komponentti.
Lisäksi SIO2 Amorfinen käytetään erityisprosessin kautta esineiden muovien pinnalla ruoan pakkaamiseksi, joka toimii esteenä.
Lääketeollisuudessa
Sitä lisätään antiapelmazante -aineena, sakeutumis-, geelin ja apuaineena, toisin sanoen, avustajana useiden lääkkeiden ja vitamiinien muodostamisessa.
Kosmetiikkateollisuudessa ja henkilökohtaisessa hoidossa
Sitä käytetään monissa tuotteissa: kasvojauheissa, luomivärissä, silmäilmäsilmoituksissa, huulipunat, väritys, meikkiruoat, talcos, jalkojen jauheet, hiusvärit ja valkaisuaine ja valkaisuaine.
Myös öljyissä ja kylpysuoloissa, vaahekauteissa, käsissä ja vartalovoidessa.
Myös yövoiteissa, kirkkaudessa ja kynsimaalissa.
Terapeuttisissa sovelluksissa
SIO2 Se on läsnä bioaktiivisessa tai biovidriosilasissa, jonka pääpiirteet ovat, että ne voivat reagoida kemiallisesti niitä ympäröivään biologiseen ympäristöön, muodostaen vahvan ja kestävän yhteyden elävään kudokseen.
Tämän tyyppinen materiaali tekee luun korvikkeet, kuten kasvojen, kuten "telineet", joissa luusolut kasvavat. Ne ovat osoittaneet hyvän biologisen yhteensopivuuden sekä luiden että pehmytkudoksen kanssa.
Nämä biovidriot antavat luut palauttaa kasvoista ihmisille, jotka ovat menettäneet ne vahingossa tai tautiin.
Riskejä
Erittäin ohuet piidioksidihiukkaset voidaan suspendoida ilmassa ja muodostaa ei -selventäviä jauheita. Mutta tämä pöly voi ärsyttää ihoa ja silmiä. Sen hengitys aiheuttaa hengitysteiden ärsytystä.
Lisäksi piidioksidipölyn hengittäminen tuottaa keuhkojen pitkäaikaisia vaurioita, joita kutsutaan silikoosiksi.
Viitteet
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Piidioksidi. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Da Silva, m.R -. et al. (2017). Vihreät uuttotekniikat. Piidioksidipohjaiset sormit. Analyyttisen kemian ymmärtämisessä. ScienEdirect.com.
- Ylänen, H. (Toimittaja). (2018). Bioaktiiviset lasit: Materiaalit, ominaisuudet ja sovellukset (toinen painos). Elsevier. Palautettu kirjoista.Google.yhteistyö.mennä.
- Windholz, m. et al. (Toimittajat) (1983) Merck -indeksi. Kemikaalien, drarugien ja biologisten aineiden tietosanakirja. Kymmenes painos. Merck & Co., Inc.
- Mätyen, J. Ja Suni, T. (2015). Paksun elokuvan Soi-kiekot. Piipohjaisten MEMS -materiaalien ja tekniikoiden käsikirjassa (toinen painos). ScienEdirect.com.
- Sirleto, L. et al. (2010). Lämpöoptiset kytkimet. Piin nanokiteet. ScienEdirect.com.
- « Kalsiumfluoridi (CAF2) rakenne, ominaisuudet, käytöt
- 275 pyropos romanttisille ja seksikkäille miehille »

