Litiumfluoridirakenne, ominaisuudet, hankkiminen, käyttö

- 789
- 178
- Gabriel Fahey
Hän Litiumfluori Se on epäorgaaninen kiinteä aine, jonka kemiallinen kaava on LIF. Muodostuu Li -ioneista+ ja f- jotka yhdistyvät ionisen siteen kautta. Sitä löytyy pieninä määrinä useissa mineraaleissa, erityisesti silikaatteja, kuten lepidoliittia, merivettä ja monissa mineraalikaivoissa.
Sillä on ollut laaja käyttö optisissa laitteissa, koska se on läpinäkyvyys laajalla aallonpituuksilla infrapunaspektristä (IR) UV -ultraviolettiin, näkyvän läpi.
 Lepidoliitti, mineraali, joka sisältää pieniä määriä elinikäistä fluoria. Rob Lavinsky, Irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons.
Lepidoliitti, mineraali, joka sisältää pieniä määriä elinikäistä fluoria. Rob Lavinsky, Irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons. Sitä on käytetty myös laitteissa vaarallisen säteilyn havaitsemiseksi työpaikoissa, joissa ihmiset ovat alttiina näille lyhyen aikaa. Lisäksi sitä käytetään materiaalina alumiinin sulamiseen tai lasien tai lasien ja keraamisen valmistuksen valmistukseen.
Se toimii materiaalina litium -ion -akkujen komponenttien peittämiseksi ja näiden lastauksen alkuperäisen menetyksen estämiseksi.
[TOC]
Rakenne
Litiumfluoridi on ioninen yhdiste, toisin sanoen, muodostuu liitoksen liitoksesta+ ja anioni f-. Voima, joka pitää ne yhdessä yhdessä, on sähköstaattinen ja sitä kutsutaan ionisidoksi.
Kun litium yhdistetään, hän antaa elektronin fluoridille, molemmat ovat stabiilia kuin alkuperäinen tapa, kuten alla selitetään.
Litiumelementillä on seuraava elektroninen kokoonpano: [he] 1s2 2s1 Ja kun annan elektronia, elektroninen rakenne on näin: [hän] 1s2 mikä on paljon vakaampaa.
Fluorielementti, jonka elektroninen kokoonpano on: [ne] 1s2 2s2 2 p5, Hyväksymällä elektroni on muoto [ne] 1s2 2s2 2 p6, vakavampi.
Nimikkeistö
- Litiumfluori
- Fluorolitio
Voi palvella sinua: ei -metalliset oksidit- Litium monofluoridi
Ominaisuudet
Fyysinen tila
Valkoinen kiinteä aine, joka kiteytyy kuutiometriä, kuten natriumkloridi NaCl.
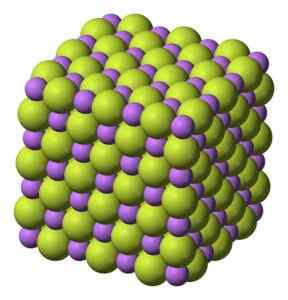 LIF -litiumfluoridikiteiden kuutiorakenne. Benjah-BMM27 [julkinen alue]. Lähde: Wikimedia Commons.
LIF -litiumfluoridikiteiden kuutiorakenne. Benjah-BMM27 [julkinen alue]. Lähde: Wikimedia Commons. Molekyylipaino
26 g/mol
Sulamispiste
848,2 ºC
Kiehumispiste
1673 ºC, vaikka se haihtutetaan nopeudella 1100-1200 ºC
Tiheys
2 640 g/cm3
Taitekerroin
1 3915
Liukoisuus
Pieni liukoinen veteen: 0,27 g/100 g vettä 18 ºC: n lämpötilassa; 0,134 g/100 g 25 ° C: ssa. Liukoinen happamassa väliaineessa. Liukenematon alkoholiin.
Muut ominaisuudet
Sen höyryillä on dimic -lajit (LIF)2 ja trimeerinen (LIF)3. HF: n fluorakivihapon kanssa muodostuu LIHF -litiumia2; Litiumhydroksidilla se muodostaa kaksinkertaisen Lif -suolan.Liia.
Hankkiminen ja sijainti
LIF -litiumfluoridi voidaan saada reaktiolla HF -fluoriahapon ja LIOH -litiumhydroksidin tai litiumlitiumkarbonaatin välillä2Yhteistyö3.
Sitä on kuitenkin pieninä määrinä tietyissä mineraaleissa, kuten lepidoliitissa ja merivedessä.
 Litiumfluoridia löytyy pieninä määrinä merivedessä. Adeeb Atwan [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)]. Lähde: Wikimedia Commons.
Litiumfluoridia löytyy pieninä määrinä merivedessä. Adeeb Atwan [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)]. Lähde: Wikimedia Commons. Sovellukset
Optisissa sovelluksissa
HIF: tä käytetään kompaktien kiteiden muodossa infrapunaspektrofotometreissä (IR) johtuen erinomaisesta dispersiosta, joka heillä on aallonpituusvälillä välillä 4000 - 1600 cm-1.
Lif Lif -kiteet saadaan tyydyttyneistä liuoksista tästä suolasta. Se voi korvata luonnolliset fluoritekiteet erityyppisissä optisissa laitteissa.
Suuria ja puhtaita kiteitä käytetään optisissa järjestelmissä ultraviolettivaloon (UV), näkyviin ja IR- ja röntgen-monokromaattoreihin (0,03-0,38 nm).
 Life Lif Fluoruro Crystal, dekantterilasan sisällä. V1adis1av [julkinen alue]. Lähde: Wikimedia Commons.
Life Lif Fluoruro Crystal, dekantterilasan sisällä. V1adis1av [julkinen alue]. Lähde: Wikimedia Commons. Sitä käytetään myös UV -alueen optisena pinnoitusmateriaalina sen laajan optisen kaistan vuoksi, suurempi kuin muiden metallifluorien,.
Se voi palvella sinua: alkalinottimet metallitHänen läpinäkyvyytensä kaukaisessa UV: ssä (90-200 nm) tekee siitä ihanteellisen suojaavan pinnoitteena alumiinipeileissä (AL). LIF/AL -peilit ovat käytetty optisissa teleskooppijärjestelmissä avaruussovelluksissa.
Nämä pinnoitteet saavutetaan höyryn ja kerroksen laskeutumisen fyysisesti atomitasolla.
Ionisoivissa tai vaarallisissa säteilynilmaisimissa
Litiumfluoridia on käytetty laajasti fotonien, neutronien ja β (beeta) säteilyn termoluminesoivissa ilmaisimissa.
Termoluminesoivat ilmaisimet pitävät säteilyn energiaa altistuessaan tälle. Myöhemmin, kun lämmitetään niitä.
Tätä sovellusta varten LIF on yleensä päivätty magnesiumvaikutuksilla (MG) ja titaanilla (TI). Nämä epäpuhtaudet tuottavat tiettyjä energiatasoja, jotka toimivat reikinä, joissa säteilyn vapauttamat elektronit ovat loukussa. Kun materiaali lämmitettiin, nämä elektronit palaavat alkuperäiseen energiatilaansa, joka säteilee valoa.
Päästetyn valon voimakkuus riippuu suoraan materiaalin absorboimasta energiasta.
LIF: n termoluminesoivat ilmaisimet on testattu onnistuneesti monimutkaisten säteilykenttien mittaamiseksi, kuten suuressa Hadron Colliderissa tai LHC: ssä (sen lyhenteen englanniksi Suuri Hadron Collider; Conseil Européen kaataa recherche -ydin-A.
Säteily siinä tutkimuksissa, jotka tehdään siinä tutkimuskeskuksessa, esittävät hadroneja, neutroneja ja elektroneja/positroneja muun tyyppisten subatomisten hiukkasten joukossa, jotka kaikki voidaan havaita HIF: llä.
Materiaalina litium -akun katodi
LIF on testattu menestyksekkäästi nanokomposiittien muodossa, joissa on koboltti (CO) ja rauta (usko) prelitifioinnin materiaaleina (englanninkielinen käännös Esitys) litium -ion -akun katodimateriaalista.
Voi palvella sinua: etyylieetteriLitiumioni -akun ensimmäisen kuormitussyklin tai muodostumisvaiheen aikana orgaaninen elektrolyytti hajoaa kiinteän vaiheen muodostamiseksi anodin pinnalle.
Tämä prosessi kuluttaa katodin litiumia ja vähentää energiaa 5 - 20% litiumioni -akun kokonaiskapasiteetista.
Tästä syystä on tutkittu katodin sähkökemiallista esitystä, mikä tuottaa nanokomposiumin litiumin sähkökemiallisen uuttamisen, joka toimii litiumluovuttajana, välttäen siten katodin litiumin kulutusta.
Nanokomposiitit LIF/CO ja LIF/FE on suuri kapasiteetti luovuttaa litium katodille, ja se on helppo syntetisoida, vakaa ympäristö- ja akkujen käsittelyolosuhteissa.
 Litiumioniakku. Kirjoittaja: MR.ちゅら さん. Litium_battery * valokuvauspäivä, elokuu 2005 * valokuvaushenkilö ANEY. Lähde: Wikimedia Commons.
Litiumioniakku. Kirjoittaja: MR.ちゅら さん. Litium_battery * valokuvauspäivä, elokuu 2005 * valokuvaushenkilö ANEY. Lähde: Wikimedia Commons. Useissa käyttötarkoituksissa
Litiumfluoridia käytetään hitsausmittarina, erityisesti alumiinissa ja hitsaustangossa. Sitä käytetään myös alumiinien pelkistyssoluissa.
Sitä käytetään laajasti lasin valmistuksessa (kuten linssien), joissa laajennuskerroin pienenee. Sitä käytetään myös keramiikan valmistuksessa. Lisäksi sitä on käytetty emalien ja lasimaisten lakkaiden valmistuksessa.
LIF on polttoainekomponentti raketteille ja polttoaineille tietyntyyppisille reaktorille.
LIF: tä käytetään myös kevyissä diodeissa tai aurinkosähkökomponenteissa, elektronien injektioon sisäisiin kerroksiin.
Viitteet
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Fluori -litium. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus.
- Obryk, b. et al. (2008). Erityyppisten TL-litiumfluoridin ilmaisimien vaste korkean energian sekoitetulle säteilykentälle. Säteilymittaukset 43 (2008) 1144-1148. ScienEdirect.com.
- Aurinko, ja. et al. (2016). Litiumfluoridi/metalli -nanokomposiitin paikallisessa kemiallisessa synteesissä katodien suuren kapasiteetin esijännityksen suhteen. Nano Letters 2016, 16, 2, 1497-1501. Pubista toipunut.ACS.org.
- Hennessy, J. ja Nikzad, S. (2018). Litiumfluoridiohtipinnoitteiden atomikerroksen saostuminen ultraviolettille. Inorganics 2018, 6, 46. MDPI toipui.com.
- « 10 Tieteellisiä kokeita fysikaaliselle toissijaiselle, kemialle, biologialle
- Metyylimalonihapon rakenne, ominaisuudet, synteesi, käyttää »

