Magnesiumfluoridirakenne, ominaisuudet, synteesi, käyttää
- 3888
- 236
- Arthur Terry II
Hän Magnesiumfluori Se on väritön epäorgaaninen suola, jonka kemiallinen kaava on Mgf₂. Sitä löytyy luonnosta Sealíta -mineraalina. Sillä on erittäin korkea fuusiopiste ja se on hyvin vähän liukeneva veteen. Se on suhteellisen inertti, koska esimerkiksi sen reaktio rikkihappoon on hidasta ja epätäydellistä ja kestää hydrolyysiä fluoriahapolla (HF) - 750ºC.
Se on yhdiste, johon korkea energian säteily vaikuttaa vähän. Lisäksi sillä on alhainen taitekerroin, korkea korroosionkestävyys, hyvä lämpöstabiilisuus, merkittävä kovuus ja erinomaiset näkyvät valonsiirtoominaisuudet, UV (ultravioletti) ja IR (infrapuna).

Näillä ominaisuuksilla on erinomainen suorituskyky optisella kentällä, ja lisäksi ne tekevät siitä hyödyllisen materiaalin, kuten katalyyttituki, pinnoituselementti, anti -refleksin linssit ja ikkunat infrapunasiirtoon, muun muassa.
[TOC]
Rakenne
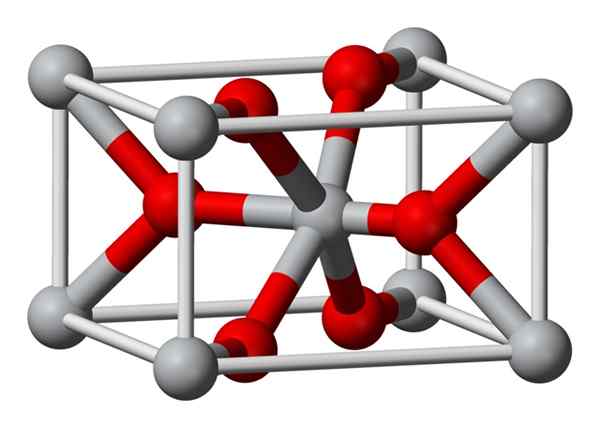
Kemiallisesti valmistetun magnesiumfluoridin kiteinen rakenne on samantyyppi kuin sellata luonnon mineraalilla. Kiteytyy tetragonaalisen järjestelmän dipiramidaaliluokassa.
Magnesiumioulit (Mg2+) sijaitsevat tetragonaalikeskeisessä avaruuskeskeisessä, kun taas fluori-ioneja (F-) löytyy samasta naapureidensa MG2+ -tasosta ja niihin liittyvät, ryhmiteltyihin pareihin jokaisen kanssa. Mg2+: n ja F-ionin välinen etäisyys on 2,07 Å (angstroms) (2,07 × 10-10m).
Sen kiteinen koordinointi on 6: 3. Tämä tarkoittaa, että jokaista MG2+ -ionia ympäröi 6 ionia F- ja jokaista ionia F-, puolestaan, ympäröi 3 mg2+ 5-ionia.
Rakenne on hyvin samanlainen kuin Rutilo -mineraali, joka on titaanidioksidin luonnollinen muoto (TiO2), jonka kanssa sillä on useita CRYFOMPIC -ominaisuuksia yhteisiä.
Saavuttamisensa aikana magnesiumfluoridi ei saostu amorfisen kiinteän aineen muodossa, koska Mg2+ ja F-ionit eivät yleensä muodosta polymeerikomplekseja liuokseen.
Ominaisuudet
On mielenkiintoista korostaa, että magnesiumfluoridi on birpressoiva materiaali. Tämä on optinen ominaisuus, jonka avulla voit avata tapahtuman valonsäteen kahteen erilliseen säteen, jotka leviävät eri aaltoilla ja aallonpituuksilla.
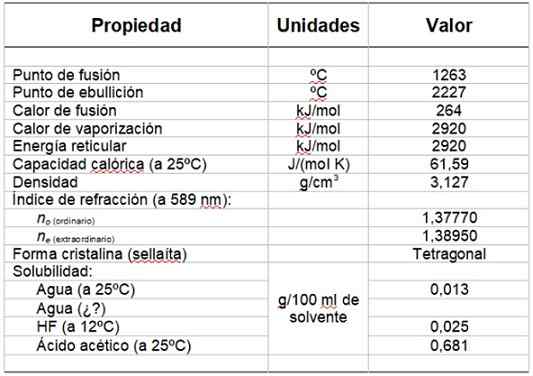
Voi palvella sinua: HydroksyyliryhmäTaulukko 1 näyttää joitain sen ominaisuuksista.
pöytä 1. Magnesiumfluoridin fysikaaliset ja kemialliset ominaisuudet.
Synteesi ja valmistelu
Se voidaan valmistaa monin tavoin, joista seuraavat voidaan mainita:
1-koska reaktio magnesiumoksidin (MGO) tai magnesiumkarbonaatin (MGCO3) välinen reaktio fluoridihapon (HF) 2: n kanssa:
MGO + 2 HF MGF2 + H2O
Mgco3 + 2 HF Mgf2 + CO2 + H2O
2-for-reaktio magnesiumkarbonaatin ja ammoniumbifluoruron (NH4HF2) välillä, molemmat kiinteässä tilassa, lämpötilassa välillä 150-400ºC2:
150-400ºC
Mgco3 + NH4HF2 Mgf2 + NH3 + CO2 + H2O
3-kalento Magnesiumkarbonaatin ja ammoniumfluoridin (NH4F) vesiliuos ammoniumhydroksidin (NH4OH) läsnä ollessa 60ºC 2: lla:
60ºC, NH4OH
Mgco3 + 3 NH4F NH4MGF3 + (NH4) 2CO3
Ammonium- ja magnesiumfluoridin (NH4MGF3) sakka kuumennetaan sitten 620ºC: seen 4 tunnin ajan magnesiumfluoridin saamiseksi:
620ºC
NH4MGF3 MGF2 + NH3 + HF
4-Beryllium (BE) ja uraanin (U) hankkimisen sivutuote (U). Halutun elementin fluori metallisella magnesiumilla lämmitetään Mgf22 -peitetyssä sulamiskantissa:
Bef2 + mg be + mgf2
5-hoitava reaktio magnesiumkloridi (Mgcl2) ammoniumfluoridilla (NH4F) vesiliuoksessa huoneenlämpötilassa 3:
25ºC, H2O
Mgcl2 + 2 nh4f mgf2 + 2nh4cl
Koska MGF2.
Voi palvella sinua: Kalsiumhydridi (CAH2): Ominaisuudet, reaktiivisuus ja käytötTälle on ominaista lisätä tarpeeksi fluori-ioneja (F-) meriveteen, jolla on runsaasti magnesiumionien pitoisuutta (mg2+), mikä suosii MGF2: n saostumista.
Optiset magnesiumfluoridikiteet saadaan kuumalla paineella korkealaatuisesta MGF2: sta, saadaan esimerkiksi NH4HF2 -menetelmällä.
Magnesiumfluoridimateriaalien, kuten yhden lasin kasvun, sintraus (tiivistyminen muottiin tai muotoon), valmistamiseksi on monia tekniikoita ilman paineita, kuumaa ja sintrauspainetta, puristettu mikroaaltouuni.
Sovellukset
Optiikka
MGF2 -kiteet sopivat optisiin sovelluksiin, koska ne ovat läpinäkyviä UV -alueelta IR -keskimäärin 2,10 alueelle.
Koska inertti -kalvoa käytetään muuttamaan optisten ja elektronisten materiaalien valonsiirtoominaisuuksia. Yksi tärkeimmistä sovelluksista on VUV -optiikassa avaruustutkimustekniikkaan.
Birressingency -ominaisuutensa vuoksi tämä materiaali on hyödyllinen polarisaatiooptiikassa, ekimeerilaser -ikkunoissa ja prismeissä (ultravioletti lasertyyppi, jota käytetään silmäleikkauksessa).
On huomattava, että ohuen kalvon optisten materiaalien valmistuksessa käytetyn magnesiumfluoridin on oltava epäpuhtauksia tai yhdisteitä, jotka ovat oksidin lähde, kuten vettä (H2O), hydroksidi-ioneja (OH-), karbonaatti-ioneja (CO3 = ), Sulfaatti -ionit (SO4 =) ja vastaavat 12.
Katalyysi tai reaktioiden kiihtyminen
MGF2: ta on käytetty menestyksekkäästi katalyytin tueksi kloorin eliminaation reaktiolle ja vedyn lisäämiselle CFC: ssä (klorofluorihiilivetyjä), hyvin tunnetut kylmäaineet ja aerosolipotkenteet, ja vastuussa ilmakehän otsonikerroksen vaurioista aiheutuvat vauriot.
Tuloksena olevat yhdisteet, HFC (hydrofluorihiilivedet) ja HCFC (hydrokloorifluorihiilivedet), eivät esitellä tätä haitallista vaikutusta ilmakehään 5.
Se on ollut hyödyllistä myös tukena katalyytteille orgaanisten yhdisteiden hydrodesulfraatiolle (rikin eliminaatio).
Voi palvella sinua: Kemiallinen tasapaino: Selitys, tekijät, tyypit, esimerkitMuut käyttötarkoitukset
Grafiitti-, fluori- ja MGF2 -lomakkeiden tuottamat materiaalit.
NAF: n ja MGF2: n muodostama Eutctic esittelee energian varastointiominaisuudet piilevässä lämmössä, joten sitä on otettu huomioon aurinkoenergiajärjestelmissä käytettäväksi.
Biokemian alueella käytetään magnesiumfluoridia yhdessä muiden metallifluoridien kanssa fosforyylin siirtoreaktioiden estämiseen entsyymeissä.
Äskettäin MGF2.
Viitteet
- Buckley, h.JA. ja Vernon, W.S. (1925) XCIV. Magnesiumfluoridin kiderakenne. Philosophical Magazine Series 6, 49: 293, 945-951.
- Kirk-Othmer (1994). Kemiallisen tekniikan tietosanakirja, osa 11, viides painos, John Wiley & Sons. ISBN 0-471-52680-0 (V.yksitoista).
- Peng, Minhong; Cao, weiping; ja laulu, Jinhong. (2015). MGF2: n läpikuultavan keraamisen valmistus kuumalla puristamalla sintraus. Lehti Wuhanin teknillisen yliopiston Mater: SCI. Ed. Osa. 30 ei. 4.
- Непоконов, и.С. (2011). Fluori -magnesium. Lähde: Oma työ.
- Wojciechowska, Maria; Zielinski, Michal; ja Piettowski, Mariusz. (2003). Mgf2 ei-konfentiona olevana katalyyttituella. Journal of Fluorin Chemistry, 120 (2003) 1-11.
- Korth Kristalle Gmbh. (2019). Fluoridimagnesium (MGF2). Kuuli 12.7.2019 julkaisussa: Korth.-
- Sevonkaev, Igor ja Matijevic, Egon. (2009). Eri morfologioiden magnesiumfluoridihiukkasten muodostuminen. Langmuu 2009, 25 (18), 10534-10539.
- Непоконов, и.С. (2013). Fluori -magnesium. Lähde: Oma työ.
- Tao Qin, Peng Zhang ja Weiwei Qin. (2017). Uusi menetelmä edullisten magnesiumfluoridipallojen syntetisoimiseksi merivedestä. Ceramics International 43 (2017) 14481-14483.
- Ullmannin teollisuuskemian tietosanakirja (1996) viides painos. Volume A11. Vch verlagsgellschaft mbh. New York. ISBN 0-89573-161-4.
- NASA (2013). Insinöörit tarkastavat Hubble Space -teleskoopin ensisijaisen peilin 8109563. Lähde: sekoitus.MSFC.potti.Hallitus
- « Piktografinen kirjoittaminen alkuperä, ominaisuudet ja esimerkit
- Kaupalliset liiketoimet ominaisuudet ja esimerkit »

