Koheesiovoima
- 4183
- 208
- Kelly Kilback
Mitkä ovat koheesiovoimat?
Se koheesiovoimat Ne ovat molekyylien välisiä vetovoimia, jotka pitävät joitain molekyylejä muiden kanssa. Koheesiovoimien voimakkuudesta riippuen aine on kiinteässä, nestemäisessä tai kaasumaisessa tilassa. Koheesiovoimien arvo on kunkin aineen luontainen ominaisuus.
Tämä ominaisuus liittyy kunkin aineen molekyylien muotoon ja rakenteeseen. Tärkeä koheesiovoimien ominaisuus on, että ne vähenevät nopeasti etäisyyden kasvaessa. Sitten niitä kutsutaan koheesiovoimiksi vetovoimavoimiin, joita esiintyy saman aineen molekyylien välillä.
Se Torjuntavoimat Ne ovat ne, jotka johtuvat hiukkasten kineettisestä energiasta (energiasta johtuen). Tämä energia aiheuttaa molekyylien olevan jatkuvasti liikkeessä. Tämän liikkeen voimakkuus on suoraan verrannollinen lämpötilaan, jossa aine on.
Aineen tilan muutoksen aiheuttamiseksi on välttämätöntä nostaa lämpötila lämmönsiirron avulla. Tämä aiheuttaa aineen torjumisen voimat kasvamaan, mikä tarvittaessa voi lopulta olettaa valtion muutoksen.
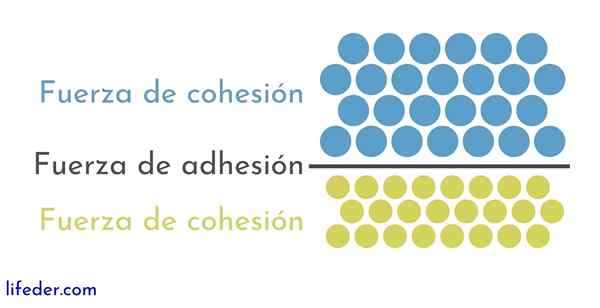
Toisaalta on tärkeää ja välttämätöntä erottaa koheesio ja tarttuvuus-
- Yhteys johtuu saman aineen vierekkäisten hiukkasten välisistä vetovoimista.
- Tarttuvuus on seurausta vuorovaikutuksesta, joka tapahtuu eri aineiden tai kappaleiden pintojen välillä.
Nämä kaksi voimaa esiintyvät useisiin fysikaalisiin ilmiöihin, jotka vaikuttavat nesteisiin, joten on tärkeää, että sekä yhdestä että toisesta on hyvä käsitys.
Se voi palvella sinua: Vy canis majoris: löytö, ominaisuudet, rakenne, koulutus ja evoluutioKoheesiovoimat kiinteissä aineissa, nesteissä ja kaasuissa
 Atomit kolmessa päätilassa
Atomit kolmessa päätilassa Kiintoaineena
Yleensä kiinteiden aineiden koheesiovoimat ovat erittäin korkeat ja annetaan voimakkaasti kolmeen avaruussuuntaan.
Tällä tavoin, jos ulkoinen voima kohdistetaan kiinteään runkoon, pienet siirtymät molekyyleistä tapahtuu keskenään.
Lisäksi, kun ulkoinen voima katoaa, koheesiovoimat ovat riittävän vahvoja palaamaan alkuperäisessä asennossaan oleviin molekyyleihin, palauttamalla sijainti ennen voiman käyttöä.
Nesteinä
Päinvastoin, nesteissä koheesiovoimat ovat korkeat vain kahdessa alueellisessa suunnassa, kun taas ne ovat erittäin heikkoja nestekerrosten välillä.
Siten, kun voimaa kohdistetaan tangentiaaliseen suuntaan nesteeseen, tämä voima rikkoo heikkoa sidoksia kerrosten välillä. Tämä aiheuttaa nestemäisten kerrosten liukumisen toisen yli.
Sitten, kun voiman levitys päättyy, koheesiovoimilla ei ole tarpeeksi voimaa nestekolekyylien sijoittamiseksi alkuperäiseen sijaintiinsa.
Lisäksi nesteissä koheesio heijastuu myös pintajännityksessä, joka johtuu nesteen sisäpuolelta suunnattu epätasapainoinen voima, joka vaikuttaa pintamolekyyleihin.
Samoin koheesiota havaitaan myös, kun siirtyminen nestemäisestä tilasta kiinteään tilaan annetaan, johtuen nestemolekyylien puristuksen vaikutuksesta.
Kaasuissa
Kaasuissa koheesiovoimat ovat halveksittavia. Tällä tavoin kaasumolekyylit ovat jatkuvassa liikkeessä, koska niiden tapauksessa koheesiovoimat eivät pysty pitämään niitä kytkettyinä toisiinsa.
Voi palvella sinua: Mekaaninen etu: Kaava, yhtälöt, laskenta ja esimerkitSiksi kaasuissa koheesiovoimat voidaan nähdä vain, kun nesteytysprosessi tapahtuu, joka tapahtuu, kun kaasumaiset molekyylit puristetaan ja vetovoiman voimat ovat riittävän vahvat tuottamaan valtion kaasumaisen siirtymisen nestemäiseen tilaan.
Esimerkkejä koheesiovoimista
Usein koheesiovoimat yhdistetään tarttuvuusvoimiin tiettyjen fysikaalisten ja kemiallisten ilmiöiden aiheuttamiseksi.
Esimerkiksi koheesiovoimat yhdessä tarttuvuuden kanssa sallivat selittää joitain yleisimpiä nesteissä esiintyviä ilmiöitä; Näin on meniski, pintajännitys ja kapillaari.
Siksi nesteiden tapauksessa on välttämätöntä erottaa koheesiovoimat, jotka tapahtuvat saman nesteen molekyylien välillä; ja tarttuvuus, joita esiintyy nesteen molekyylien ja kiinteän aineen välillä.
Pintajännitys

Pintajännitys on voima, joka esiintyy tangentiaalisesti ja pituusyksikköä kohti tasapainossa olevan nesteen vapaan pinnan reunalla. Tämä voima supistaa nestemäisen pinnan.
Viime kädessä pintajännitys tapahtuu, koska nestemolekyyleissä esiintyvät voimat ovat erilaisia nesteen pinnalla kuin ne, jotka tapahtuvat.
Meniski
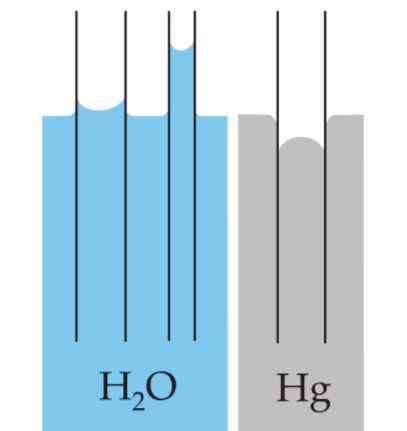
Nesteiden pinnalle luotu kaarevuus kutsutaan meniskiksi, kun se on rajoitettu säiliöön. Tätä käyrää syntyy sen vaikutuksen perusteella.
Voi palvella sinua: painomittaritKäyrä voi olla kupera tai kovera, riippuen siitä, onko nesteen ja säiliön molekyylien välinen voima vetovoimaa - kuten veden ja lasin tapauksessa - vai ovat heikkenemistä, kuten elohopean ja lasin välillä.
Kapillaarisuus
 Esimerkki kapillaarisuudesta
Esimerkki kapillaarisuudesta Kapillaarisuus on nesteiden ominaisuus, jonka avulla ne voivat nousta tai laskeutua kapillaariputken läpi. Kiinteistö sallii osittain veden nousun kasvien sisällä.
Neste nousee kapillaariputken läpi, kun koheesiovoimat ovat alhaisemmat kuin nesteen ja putken seinien välisen tarttumisen. Tällä tavalla neste kasvaa edelleen, kunnes pintajännityksen arvo on yhtä suuri kuin kapillaariputken sisältämän nesteen paino.
Päinvastoin, jos koheesiovoimat ovat korkeammat kuin tarttumisen, pintajännitys laskee nesteeseen ja sen pinnan muoto on kupera.
Viitteet
- Koheesio (kemia) (n.d -d.-A. Wikipediassa. Haettu jstk.Wikipedia.org.
- Pintajännitys (n.d -d.-A. Wikipediassa. Haettu jstk.Wikipedia.org.
- Kapillaarisuus (n.d -d.-A. Wikipediassa. ES: stä palautettu.Wikipedia.org.
- Iranin. Levine; "Fysikakemia", osa 1; Viides painos; 2004; MC Graw Hillm.
- Moore, John W.; Stanitski, conrad l.; Jurs, Peter C. (2005). Kemia: Molekyylitiede. Belmont, Kalifornia: Brooks/Cole.
- Valkoinen, Harvey ja. (1948). Moderni korkeakoulufysiikka. Pakettiauto.


