Molekyyligeometriakonsepti, tyypit ja esimerkit
- 1839
- 445
- Eddie Hackett
Se Molekyyligeometria jompikumpi molekyylirakenne Se on atomien alueellinen jakautuminen keskusatomin ympärillä. Atomit edustavat alueita, joilla on korkea elektroninen tiheys, ja siksi niitä pidetään elektronisryhminä riippumatta muodostavista linkeistä (yksinkertainen, kaksinkertainen tai kolminkertainen).
Elementin molekyyligeometria voi karakterisoida joitain sen fysikaalisia tai kemiallisia ominaisuuksia (kiehumispiste, viskositeetti, tiheys jne.-A. Esimerkiksi veden molekyylirakenne määrittää sen liukoisuuden.
 Lähde: Gabriel Bolívar
Lähde: Gabriel Bolívar Tämä konsepti syntyy kahden teorian yhdistelmästä ja kokeellisesta tiedosta: Valencia -linkin (TEV) ja Valencia -kerroksen elektronisten parien (RPECV) torjuminen (RPECV). Vaikka ensimmäinen määrittelee yhteydet ja niiden kulmat, toinen luo geometrian ja siten molekyylirakenteen.
Mitkä geometriset muodot kykenevät omaksumaan molekyylejä? Kaksi aikaisempaa teoriaa lisäävät vastauksia. RPECV: n mukaan vapaiden elektronien atomit ja parit on järjestettävä avaruuteen siten, että niiden välinen sähköstaattinen torjuminen vähenee maksimiin.
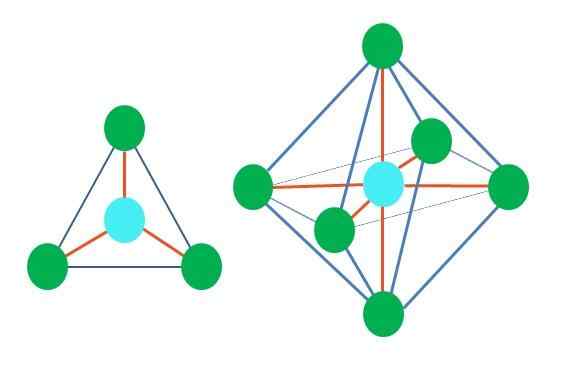
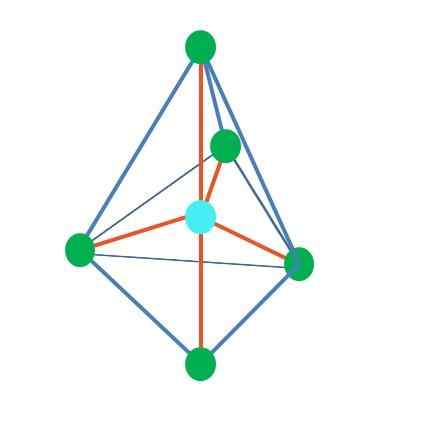
Joten geometriset muodot eivät ole mielivaltaisia, vaan etsivät vakainta suunnittelua. Esimerkiksi ylemmässä kuvassa kolmio näkyy vasemmalla ja oikealla oktaedrilla. Vihreät pisteet edustavat atomeja ja oransseja raidat linkit.
Kolmiossa kolme vihreää pistettä on suunnattu 120º: n erotukseen. Tämä linkin kuin linkin kulma antaa atomien torjua toisiaan mahdollisimman. Siksi molekyyli, jonka keskusatomi on kiinnitetty kolmeen muuhun, ottaa käyttöön tasaisen trigonaalisen geometrian.
RPECV ennustaa kuitenkin, että pari vapaita elektroneja keskusatomisessa vääristää geometriaa. Trigonaalisen tason tapauksessa tämä vääntömomentti työntää kolme vihreää pistettä alas, mikä johtaa trigonaaliseen pyramidigeometriaan.
Sama voi tapahtua myös kuvan oktaedron kanssa. Siinä kaikki atomit on erotettu mahdollisimman vakaimmalla tavalla.
[TOC]
Kuinka tietää etukäteen atomin x molekyyligeometria?
Tätä varten on myös tarpeen harkita ilmaisia elektroneja elektronisina ryhminä. Nämä määrittelevät yhdessä atomien kanssa Elektroninen geometria, joka on erottamaton molekyyligeometrian seuralainen.
Elektronisesta geometriasta ja havaittuaan vapaiden elektronien parit Lewis -rakenteella, voidaan todeta, mikä molekyyligeometria tulee olemaan. Kaikkien molekyyligeometrioiden summa tarjoaa luonnoksen globaalista rakenteesta.
Molekyyligeometrian tyypit
Kuten pääkuviossa voidaan nähdä, molekyyligeometria riippuu siitä, kuinka monta atomia ympäröi keskusatomia. Jos pari elektronia on läsnä ilman jakamista, se muuttaa geometriaa, koska sillä on paljon äänenvoimakkuutta. Siksi sillä on steerinen vaikutus.
Tämän mukaan geometria voi esittää sarjan ominaismuotoja monille molekyyleille. Ja tässä syntyy erityyppisiä molekyyligeometriaa tai molekyylirakennetta.
Milloin geometria on yhtä suuri kuin rakenne? Molemmat merkitsevät samaa vain tapauksissa, joissa rakenteessa ei ole enemmän kuin yhtä geometriatyyppistä; Muutoin kaikki läsnä olevat tyypit on otettava huomioon ja annettava rakenteelle globaali nimi (lineaarinen, haarautunut, globaali, litteä jne.-A.
Voi palvella sinua: HydrceGeometriat ovat erityisen hyödyllisiä selittämään kiinteän aineen rakenne sen rakenteellisista yksiköistä.
Lineaarinen
Kaikki kovalenttiset sidokset ovat suuntaisia, joten A-B-linkki on lineaarinen. Mutta onko molekyyli ab lineaarinen2? Jos näin on, geometria on yksinkertaisesti esitetty seuraavasti: B-A-B. Kaksi B -atomia erotetaan kulmalla 180º, ja TEV: n mukaan A: n on oltava hybridi -SP -orbitaalit.
Kulma-
 Lähde: Gabriel Bolívar
Lähde: Gabriel Bolívar AB -molekyylin lineaarinen geometria voidaan olettaa ensinnäkin2; On kuitenkin välttämätöntä tehdä Lewisin rakenne ennen johtopäätöksen tekemistä. Piirtänyt Lewisin rakenteen, voit tunnistaa harvinaisten elektroniparien lukumäärän (:) A: n atomilla.
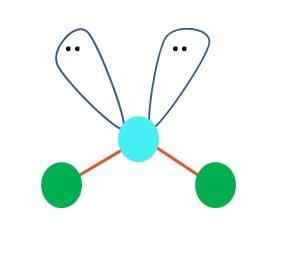
Kun näin on, elektronien parilla kaksi atomia Bown, muuttaen kulmiaan. Seurauksena on, että B-A-B-lineaarinen molekyyli lopulta tulee A V, bumerang tai kulmageometria (ylivoimainen kuva)
Vesimolekyyli, H-O-H, on ihanteellinen esimerkki tämän tyyppiselle geometrialle. Happiatomisessa on kaksi paria elektronia jakamatta, jotka on suunnattu 109º: n likimääräiseen kulmaan.
Miksi tämä kulma? Koska elektroninen geometria on tetraedrinen, jolla on neljä kärkipistettä: kaksi H -atomille ja kaksi elektroneille. Huomaa ylemmässä kuvassa, että vihreät pisteet ja kaksi "silmillä olevaa lohkoa" piirtävät tetraedron sinertävän pisteen keskellä.
Jos tai ei olisi vapaita elektroneja, vesi muodostaa lineaarisen molekyylin, sen napaisuus vähenee ja valtameret, meret, järvet jne., Niitä ei todennäköisesti olisi olemassa, koska he tuntevat toisensa.
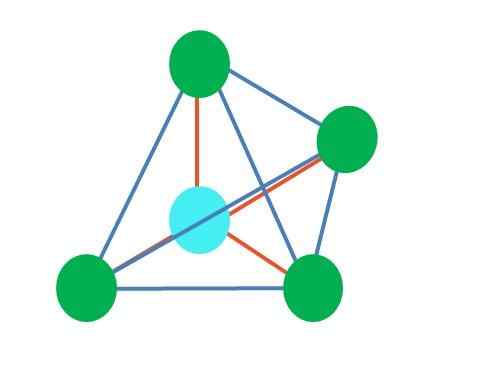
Tetraedrinen
 Lähde: Gabriel Bolívar
Lähde: Gabriel Bolívar Yläkuva edustaa tetraedrista geometriaa. Vesimolekyylille sen elektroninen geometria on tetraedrinen, mutta eliminoimalla elektroni -vapaat parit voidaan huomata, että se muuttuu kulmageometriaksi. Tätä havaitaan myös yksinkertaisesti poistamalla kaksi vihreää pistettä; Jäljellä olevat kaksi piirtävät V: n sinisellä pisteellä.
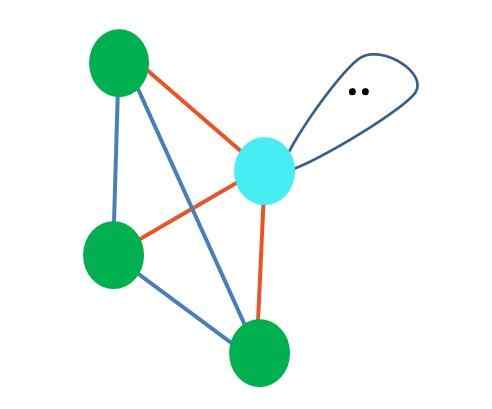
Entä jos kahden vapaiden elektronien parin sijasta olisi vain yksi? Sitten olisi trigonaalinen taso (pääkuva). Elektronisen ryhmän poistamisella vapaiden elektronien parin tuottamaa steeristä vaikutusta ei kuitenkaan vältetä. Siksi se vääristää trigonaalista tasoa kolmionmuotoiseen pohjapyramidiin:
 Lähde: Gabriel Bolívar
Lähde: Gabriel Bolívar Vaikka molekyyligeometria trigonaalinen ja tetraedrinen pyramidi ovat erilaisia, elektroninen geometria on sama: tetraedrinen. Joten trigonaalista pyramidia ei lasketa elektroniseksi geometriaksi?
Vastaus on kieltävä, koska se on "silmillä olevan lohkon" aiheuttaman vääristymisen tuote ja sen steerinen vaikutus, ja sanoi, että geometria ei ota huomioon myöhempää vääristymiä.
Tästä syystä on aina tärkeää määrittää ensimmäinen elektroninen geometria Lewis -rakenteiden avulla ennen molekyyligeometrian määrittelyä. Ammoniakkimolekyyli, NH3, Se on esimerkki molekyyligeometriasta, joka on trigonaalinen pyramidi, mutta tetraedrisella elektronisella geometrialla.
Trigonaalinen bipiramidi
 Lähde: Gabriel Bolívar
Lähde: Gabriel Bolívar Tähän saakka, lineaarista geometriaa lukuun ottamatta, tetraedrallisissa, kulma- ja trigonaalisissa pyramidissa niiden keskusatomeilla on SP -hybridisaatio SP3, TEV: n mukaan. Tämä tarkoittaa, että jos sen linkkikulut määritetään kokeellisesti, niiden tulisi olla noin 109º.
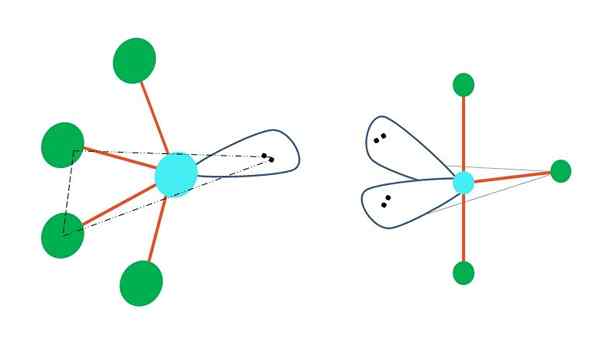
Se voi palvella sinua: Sovellettu kemia: Opiskelua, oksat, merkitys, esimerkitTrigonaalisesta difarmidigeometriasta keskusatomin ympärillä on viisi elektronista ryhmää. Yläkuvassa voit nähdä viidellä vihreällä pisteellä; Kolme kolmionmuotoisessa pohjassa ja kaksi aksiaalisissa asennoissa, jotka ovat pyramidin ylempi ja alempi kärki.
Millä hybridisaatiolla on sitten sininen piste? Se tarvitsee viisi hybridi -orbitaalia yksinkertaisten (oranssien) sidosten muodostamiseksi. Tämä saavuttaa sen viiden orbitaalin SP: n kautta3D (kiertoradan S -seoksen tuote, kolme p ja yksi d).
Kun tarkastellaan viittä elektronista ryhmää, geometria on jo altistunut, mutta sillä on elektroniparit ilman jakamista, se kärsii jälleen vääristymistä, jotka tuottavat muita geometrioita. Samoin herättää seuraava kysymys: Nämä parit voivat miehittää minkä tahansa pyramidin sijainnin? Nämä ovat: aksiaalinen tai päiväntasaaja.
Aksiaaliset ja päiväntasaajat
Vihreät kohdat, jotka muodostavat kolmionmuotoisen pohjan, ovat päiväntasaajan asennoissa, kun taas kaksi ylemmässä ja alarajassa. Missä edullisesti elektronipari sijaitsee ilman jakamista? Siinä asennossa, joka pienenee suurimpaan sähköstaattiseen torjumiseen ja steeriseen vaikutukseen.
Aksiaalisessa asennossa elektronipari tekisi ”painetta” kohtisuoraa (90º) kolmion perusteellisesti, kun taas se, että se olisi päiväntasaajan asennossa, pohjan jäljellä olevat elektroniset ryhmät erotettaisiin 120º ja paina kaksi päätä 90º: n sijaan (sijasta sijasta sen sijaan kolme, kuten pohjan kanssa).
Siksi keskusatomi pyrkii ohjaamaan elektronitonta ikätovereitaan päiväntasaajan asemissa tuottamaan stabiilia molekyyligeometriaja.
Värähtely ja T -muoto
 Lähde: Gabriel Bolívar
Lähde: Gabriel Bolívar Jos yksi tai useampi sen atomeista, jotka eivät ole elektroneja.
Yläkuvan vasemmalla puolella geometria muuttuu värähtelevään muotoon. Siinä elektronitön vääntömomentti työntää loput neljä atomia samaan suuntaan, taivuttaen niiden linkit vasemmalle. Huomaa, että tämä vääntömomentti ja kaksi atomia on alkuperäisen bipiramidin samassa kolmionmuotoisessa tasossa.
Ja kuvan oikealla puolella, geometria T -muodossa. Tämä molekyyligeometria on seurausta kahden atomin korvaamisesta kahdella elektroniparilla, jolloin jäljellä olevat kolme atomia kohdistuu samaan tasoon, joka vetää tarkalleen kirjaimen T.
Joten tyyppimolekyylille AB5, Tämä hyväksyy trigonaalisen bipyramidigeometrian. Kuitenkin ab4, Samalla elektronisella geometrialla se ottaa käyttöön värähtelevän geometrian; ja AB3, T -muotoinen geometria. Kaikissa heissä on (yleensä) SP -hybridisaatio3d -d.
Molekyyligeometrian määrittämiseksi on välttämätöntä piirtää Lewis -rakenne ja siksi sen elektroninen geometria. Jos tämä on trigonaalista bipiramidia, elektronittomat parit hylätään sitten, mutta eivät niiden steeriset vaikutukset muihin atomeihin. Siten se voidaan havaita täydellisesti kolmen mahdollisen molekyyligeometrian välillä.
Oktaedrinen
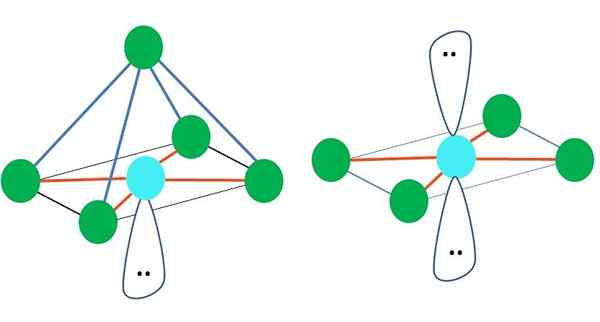
Pääkuvan oikealla puolella Oktaedrinen molekyyligeometria on esitetty. Tämäntyyppinen geometria vastaa AB -yhdisteitä6. Ab4 Ne muodostavat neliön pohjan, kun taas loput kaksi B asemasta itsensä aksiaalisiin asentoihin. Siten muodostuu useita tasapainon kolmioita, jotka ovat oktaedron kasvoja.
Voi palvella sinua: aktivointienergiaTäällä taas voi olla (kuten kaikissa elektronisissa geometrioissa) vapaat elektroniparit, ja siksi johdetaan tästä tosiasiasta, että muut molekyyligeometriat. Esimerkiksi AB5 Oktronistisella elektronisella geometrialla se koostuu pyramidista, jolla on neliöpohja, ja AB4 neliötasosta:
 Lähde: Gabriel Bolívar
Lähde: Gabriel Bolívar Oktronistisen elektronisen geometrian tapauksessa nämä kaksi molekyyligeometriaa ovat stabiilimpia sähköstaattisen torjumisen suhteen. Neliön tasaisessa geometriassa kaksi elektroniparia erotetaan 180º.
Mikä on atomin hybridisaatio näissä geometrioissa (tai rakenteissa, jos se on ainoa)? Jälleen TEV osoittaa, että se on SP3d -d2, Kuusi hybridi -kiertorataa, jonka avulla voit ohjata elektronisia ryhmiä oktaedron kärkipisteissä.
Muut molekyyligeometriat
Tähän mennessä mainittujen pyramidien emäksiä modifioimalla voidaan saada joitain monimutkaisempia molekyyligeometrioita. Esimerkiksi viisikulmainen bipiramidi perustuu viisikuntiin ja muodossa olevilla yhdisteillä on yleinen kaava AB7.
Kuten muutkin molekyyligeometriat, B -atomien korvaaminen elektronilla vapaat parit vääristävät geometriaa muihin muotoihin.
Myös yhdisteet ab8 He voivat omaksua geometriat, kuten neliömäinen antiprismi. Jotkut geometriat voivat tulla erittäin monimutkaisiksi, etenkin AB -kaavoille7 Tästä lähtien12-A.
Molekyyligeometriaesimerkkejä
Jäljempänä mainitaan sarja yhdisteitä jokaiselle päämolekyyligeometrialle. Harjoituksena Lewis -rakenteita voitaisiin piirtää kaikille esimerkeille ja varmentaa, jos saadaan elektroninen geometria, molekyyligeometriat saadaan, kuten ne on lueteltu alla.
Lineaarinen geometria
-Etyleeni, h2Cedar2
-Berylliumkloridi, becl2 (Cl-be-cl)
-Hiilidioksidi, CO2 (O = c = o)
-Typpi, n2 (NÖn)
-Mercury Dibromure, HGBR2 (BR-HG-BR)
-Triyoduro anion, minä3- (I-i-i)
-MadeHydric-happo, HCN (H-N˙c)
Sen kulmien on oltava 180º, ja siksi SP -hybridisaatio.
Kulmageometria
-Vettä
-Rikkidioksidi, niin2
-Typpidioksidi, ei2
-Otsoni tai3
-Amiduro anion, nh2-
Trigonaalinen asunto
-Bromitrifluoridi, bf3
-Alumiinitrikloridi, Alcl3
-Nitraatti -anioni, ei3-
-Karbonaatti -anioni, CO32-
Tetraedrinen
-Kaasu metano, ch4
-Hiilitetrakloridi, CCL4
-Ammoniumkation, NH4+
-Sulfaattianioni, niin42-
Trigonaalinen pyramidi
-Ammoniakki, NH3
-Hydroniokation, H3JOMPIKUMPI+
Trigonaalinen bipiramidi
-Fosfori pentafluoruro, pf5
-Antimon Pentakloridi, SBF5
Värähtelevä
Rikkitetrafluoridi, SF4
T -muoto
-Joditrikloridi, ICL3
-Kloorin trifluoridi, CLF3 (Molemmat yhdisteet tunnetaan interhalogeeneinä)
Oktaedrinen
-Heksafluoruro rikki, sf6
-Seleeni Hexafluoruro, Sef6
-Heksaflorofosfaatti, pf6-
Molekyylin geometria on se, joka selittää aineen kemiallisten tai fysikaalisten ominaisuuksien havainnot. Se on kuitenkin suunnattu elektronisen geometrian mukaan, niin että jälkimmäinen on aina määritettävä ennen ensimmäistä.
Viitteet
- Whitten, Davis, Peck & Stanley. Kemia. (8. ed.-A. Cengage Learning, P 194-198.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos., p. 23, 24, 80, 169). MC Graw Hill.
- Merkki E. Tuckerman. (2011). Molekyyligeometria ja VSEPR -teoria. Toipunut: NYU.Edu
- Virtuaalinen kemikirja, Charles ja. Ophardt. (2003). Johdatus molekyyligeometriaan. Palautettu: kemia.jalos.Edu
- Kemian librettexts. (8. syyskuuta 2016). Molekyylien geometria. Palautettu: Chem.Librettexts.org

