Glykogeenirakenne, synteesi, hajoaminen, toiminnot
- 815
- 74
- Eddie Hackett
Hän Glykogeeni Se on useimpien nisäkkäiden varastointihiilihydraatti. Hiilihydraatteja kutsutaan yleisesti sokereiksi ja ne luokitellaan hydrolyysin (monosakkaridit, disakkaridit, oligosakkaridit ja polysakkaridit) aiheuttaman jätteen lukumäärän mukaan).
Monosakkaridit ovat yksinkertaisimpia hiilihydraatteja, jotka luokitellaan niiden rakenteen sisältämien hiilihiilien lukumäärän mukaan. Siellä on triosas (3C), tetrosas (4C), pentosat (5C), heksosous (6C), heptosaasi (7c) ja oktosa (8c).
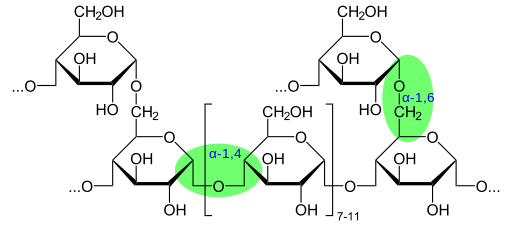
 Kemiallinen glykogeenirakenne, joka osoittaa glykosidisia sidoksia (lähde: Glykogeeni.SVG: Neurotoger -johdannainen työ: Marek M [julkinen alue] Wikimedia Commonsin kautta)
Kemiallinen glykogeenirakenne, joka osoittaa glykosidisia sidoksia (lähde: Glykogeeni.SVG: Neurotoger -johdannainen työ: Marek M [julkinen alue] Wikimedia Commonsin kautta) Aldehydiryhmän tai Cetona -ryhmän läsnäolon mukaan nämä monosakkaridit luokitellaan myös Aldies tai Ketosas.
Disakkaridit aiheuttavat hydrolyysiä, kaksi yksinkertaista monosakkaridia, kun taas oligosakkaridit tuottavat 2-10 yksikköä monosakkarideja ja polysakkarideja tuottavat yli 10 monosakkaridia.
Glykogeeni on biokemiallisesta näkökulmasta polysakkaridia, joka koostuu kuuden hiilihiilisen aldoosin haarautuneista ketjuista, toisin sanoen heksaosiksi, joka tunnetaan nimellä glukoosi. Graafisesti sitä voidaan edustaa glykogeeniksi glukoosipuuna. Tätä kutsutaan myös eläin tärkkelykseksi.
Glukoosi kasveissa varastoidaan tärkkelyksenä ja eläiminä glykogeenina, jota varastoidaan pääasiassa maksassa ja lihaskudoksessa.
Maksassa glykogeeni voi muodostaa 10% sen massasta ja 1% lihasmassasta. Kuten 70 kg: n miehessä, maksa painaa noin 1800 g ja lihakset noin 35 kg, lihasglykogeenin kokonaismäärä on paljon suurempi kuin maksa.
[TOC]
Rakenne
Glykogeenin molekyylipaino voi saavuttaa 108 g/mol, mikä vastaa 6 x 105 glukoosimolekyyliä. Glykogeeni koostuu useista haarautuneista a-d-glykoosiketjuista. Glukoosi (C6H12O6) on aldoheksosa, joka voidaan edustaa lineaarisella tai syklisellä tavalla.
Glykogeenillä on erittäin haarautunut ja kompakti rakenne, jonka ketjuja on 12-14 glukoosijäte a-d-glukoosin muodossa, jotka on kytketty a- (1 → 4) glukosidisidoksiin,. Ketjuhankot muodostetaan α- (1 → 6) glukosidiyhteyksillä.
Glykogeeni, kuten ruokavaliossa nautittu tärkkelys, tarjoaa suurimman osan hiilihydraateista, joita keho tarvitsee. Suolistossa nämä polysakkaridit hajoavat hydrolyysillä ja imeytyvät sitten kohti verenkiertoainetta pääasiassa glukoosina.
Kolme entsyymiä: ß-amylaasi, a-amylaasi ja amylo-a- (1 → 6) -glukosidaasi ovat vastuussa sekä glykogeenin että tärkkelyksen suoliston hajoamisesta.
Α-amylaasi hydrolysoi satunnaisesti sekä glykogeenin että tärkkelyksen sivuketjujen a-sidoksia (1 → 4) ja saa siksi endoglysidaasin nimen. Ss-amyla on eksoglicosidaasi, joka vapauttaa ß-maltose-dímeros-katkaisua α- (1 → 4) glykosidiset yhteydet uloimpien ketjujen päistä saavuttamatta seurauksia saavuttamatta seurauksia.
Kun otetaan huomioon, että ß-amylaasi tai a-amylaasi hajoaa haaraa, sen vaikutuksen lopputuote on erittäin haarautunut rakenne, joka on noin 35-40 glukoositähteitä, joita kutsutaan raja-dekstriiniksi.
Raja-dekstriini hydrolysoidaan lopulta haarapisteissä, joilla on α- (1 → 6) sidokset amyle-a- (1 → 6) -glukosidaasin läpi, joka tunnetaan myös nimellä "Defamay" entsyymi. Tämän defloatin vapauttamat ketjut ovat hajotettu ß-amylaasilla ja a-amylaasilla.
Kun nautittu glykogeeni tulee glukoosiksi, organismin on syntetisoitava kudoksista löydetty glukoosi.
Voi palvella sinua: Puriinit: Ominaisuudet, rakenne, toiminnotSynteesi
Glykogeenisynteesiä kutsutaan glykogeneesiksi ja tapahtuu erityisesti lihaksessa ja maksassa. Glukoosi, joka saapuu organismiin ruokavaliolla, kulkee verenkierron torrentille ja sieltä solujen sisällä, missä se fosforyloi heti glykokinaasi -nimellä entsyymi.
Glukokinaasifosforyyyli glukoosiin hiilessä 6. ATP tarjoaa fosforia ja energiaa tähän reaktioon. Seurauksena on, että glukoosi 6-fosfaatti muodostuu ja ADP vapautuu. Sitten 6-fosfaattiglukoosista tulee glukoosi 1-fosfaatti fosfoglukomutaasin vaikutuksella, joka mutaa fosforia asemasta 6 asentoon 1.
1-fosfaattiglukoosi aktivoidaan glykogeenisynteesille, mikä merkitsee kolmen muun entsyymin joukon osallistumista: UDP-glysoosipyrofosforylaasi, synteettinen glykogeeni ja amilo- (1,4 → 1,6)-glicosyylitransferaasi.
Glukoosi-1-fosfaatti yhdessä trifosfaatin uridiinin (UTP, uridiinin trifosfaatin nukleosidi) kanssa ja UDP-glykoosi-pyrofosfosforylaasin vaikutuksella muodostavat difosfaatti-glukoosin uridiinikompleksin (UDP GLC) (UDP) (UDP) (UDP) (UDP) (UDP) (UDP) (UDP) (UDP) (UDP) (UDP). Prosessissa pyrofosfaatti -ioni hydrolysoidaan.
Sitten syntetillinen glykogeenentsyymi muodostaa glukosidisen sidoksen UDP GLC -kompleksin C1: n ja glykogeenin glukoositerminaalijäämän C4: n välillä, ja UDP: n UDP vapautuu UDP -aktivoidusta glukoosikompleksista. Tämän reaktion tapahtumiseksi on oltava olemassa esiintyvä glykogeenimolekyyli, nimeltään "primaarinen glykogeeni".
Ensisijainen glykogeeni syntetisoidaan alkeisella proteiinilla, glykogeniinilla, jolla on 37 kDa ja Glysila tyrosiinitähteessä käyttämällä UDP GLC -kompleksia. Sieltä ne on kytketty α-D-glukoosijätettä 1 → 4 linkillä ja muodostetaan pieni ketju, jolle synteesiglykogeeni toimii.
Kun alkuperäinen ketju linkittää vähintään 11 glukoositähdettä, haarautumis- tai amile -entsyymi- (1,4 → 1,6) -glisyylitransferaasi siirtää ketjun 6 tai 7 glukoosijätteestä viereiseen ketjuun asennossa 1 → 6, joka muodostaa haaran kohta. Näin rakennettu glykogeenimolekyyli kasvaa lisäämällä glukoosiyksiköitä, joissa on glykosidiset linkit 1 → 4 ja enemmän seurauksia.
Heikkeneminen
Glykogeenin hajoamista kutsutaan glukogenolyysiksi, eikä se vastaa sen synteesin käänteistä polkua. Tämän reitin nopeutta rajoittaa fosforylaasin glykogeenin katalysoiman reaktion nopeus.
Fosforialillaasin glykogeeni vastaa glykogeeniketjujen linkkien 1 → 4 halkeamisesta (fosforolyysistä) vapauttaen glukoosi 1-fosfaattia. Entsymaattinen vaikutus alkaa uloimpien ketjujen päistä ja poistetaan peräkkäin, kunnes 4 glukoositähdettä pysyy seurausten molemmilla puolilla.
Sitten toinen entsyymi, α- (1 → 4) → α- (1 → 4) glucano-siirtot jättävät haarapisteen paljastettuna siirtämällä trisakkaridiyksikkö haarasta toiseen toiseen. Tämä sallii amilo- (1 → 6) -glukosidaasin (epävaka -entsyymi) hydrolys. Näiden entsyymien yhdistelmävaikutus loppuu kokonaan glykogeeniin.
Koska fosfomutaasin alkuperäinen reaktio on palautuvaa, glukoositähteistä voidaan muodostaa 6-fosfaattiglukoosi. Maksassa ja munuaisessa, mutta ei lihaksessa, on entsyymi, glukoosi-6-fosfataasi, joka kykenee keräämään 6-fosfaattihieniin glukoosiin ja muuttamaan sen vapaana glukoosiksi.
Voi palvella sinua: FotolyysiDefosforyloitu glukoosi voi levitä vereen, ja näin maksan glykogenolyysi heijastuu verensokeriarvojen nousussa (glykemia).
Synteesin ja hajoamisen säätely
Synteesi
Tätä prosessia käytetään kahdessa perus entsyymissä: synteesasien glykogeeni ja fosforylaasiglykogeeni, joten kun toinen niistä aktivoidaan, toinen on passiivisessa tilassa. Tämä säätely estää synteesin ja hajoamisen vastakkaisia reaktioita samanaikaisesti.
Molempien entsyymien aktiivinen muoto ja inaktiivinen muoto on hyvin erilainen, ja fosforylaasin ja synteettisen glykogeenin aktiivisten ja inaktiivisten muotojen välinen kääntyminen on tiukasti hormonaalista kontrollia.
Adrenaliini on hormoni, joka vapautuu lisämunuaisesta, ja glukagon on toinen, joka tapahtuu haiman endokriinisessä osassa. Endokriininen haima tuottaa insuliinia ja glukagonia. Langerhans -saarekkeet α ovat niitä, jotka syntetisoivat glukagonin.
Adrenaliini ja glukagon ovat kaksi hormonia, jotka vapautuvat, kun energiaa tarvitaan vasteena verensokeritasojen laskuun. Nämä hormonit s.
Vaikka adrenaliini käyttää vaikutustaan lihakseen ja maksaan, glukagon toimii vain maksassa. Nämä hormonit liitetään valkosolujen spesifisiin kalvoreseptoreihin, jotka aktivoivat Cyclasa Adenilaatin.
Syklaasin adenylaatin aktivointi aloittaa entsymaattisen vesiputouksen, joka toisaalta aktivoi AMPC: stä riippuvan proteinkinaasin, joka inaktiivinen synteettinen glykogeeni ja aktivoi glykogeenifosforylaasin fosforylaatiolla (vastaavasti suoraan ja epäsuorasti).
Luustolihaksella on toinen mekanismi fosforylaasin glykogeenin aktivoitumiseksi kalsiumin kautta, joka vapautuu lihaskalvon depolarisaation seurauksena supistumisen alussa.
Heikkenemistä
Edellä kuvattujen entsymaattiset vesiputoukset kasvavat glukoositasot ja kun ne saavuttavat tietyn tason, glykogeneesi aktivoituu ja glukogenolyysi estetään, estäen myös adrenaliinin ja glukagonin edelleen vapautumista.
Glykogeneesi aktivoidaan fosfataasifosforylaasin aktivoinnilla, entsyymillä, joka säätelee glykogeenisynteesiä useilla mekanismeilla, jotka tarkoittavat kinaasifosforylaasin ja fosforylaasin α inaktivoinnin, joka on synteesasin glykogeeni -inhibiittori.
Insuliini edistää glukoosin pääsyä lihassoluihin, mikä lisää 6-fosfaattien glukoositasoja, mikä stimuloi synteteesasasin glykogeenin defosforylaatiota ja aktivointia. Siten synteesi alkaa ja glykogeenin hajoaminen on estetty.
Funktiot
Lihasglykogeeni muodostaa lihaksen energiavarannon, joka, kuten varantorasvojen, antaa lihaksen suorittaa toiminnot. Koska glukoosilähde on, lihasglykogeenia käytetään harjoituksen aikana. Nämä varaukset kasvavat fyysisen koulutuksen myötä.
Maksassa glykogeeni muodostaa myös tärkeän varantolähteen sekä elimen toiminnoille että glukoosin vaikutukselle muuhun kehoon.
Tämä maksan glykogeenin funktio johtuu siitä, että maksa sisältää 6-fosfataasin glukoosia, entsyymiä, joka kykenee poistamaan 6-fosfaattihien glukoosiryhmän ja muuttamaan sen vapaasti glukoosiksi. Vapaa glukoosi, toisin kuin fosforyloitu glukoosi, voidaan levittää hepatosyyttikalvon (maksasolut) läpi.
Se voi palvella sinua: itiö: kasveissa, sienissä ja bakteereissaNäin maksa voi tarjota glukoosin verenkiertoon ja ylläpitämään stabiileja glukoositasoja, jopa pitkittyneissä paasto -olosuhteissa.
Tällä toiminnolla on suuri merkitys, koska aivot ravitaan melkein yksinomaan verensokerista, joten vaikea hypoglykemia (erittäin alhaiset verensokeripitoisuudet) voi aiheuttaa tiedon menetystä.
Liittyvät sairaudet
Glykogeeniin liittyvät sairaudet saavat "glykogeenin varastointitaudit" yleisen nimen.
Nämä sairaudet muodostavat ryhmän perinnöllisiä patologioita, joille on ominaista epänormaalien määrien tai glykogeenityyppien talletus.
Suurin osa glykogeenin varastointitaudista johtuu glykogeenimetaboliaan osallistuvien entsyymien geneettisestä luonnevajeesta.
Ne luokitellaan kahdeksaan tyyppiin, joista suurimmalla osalla on omat nimensä ja jokainen niistä tuottaa erilainen entsymaattinen alijäämä. Jotkut ovat kuolevaisia hyvin varhaisissa elämänvaiheissa, kun taas toisiaan liittyy lihasheikkous ja alijäämä liikunnan aikana.
Erinomaiset esimerkit
Jotkut näkyvimmistä glykogeeniin liittyvistä sairauksista ovat seuraavat:
- Von Gierken tauti tai tyypin I glykogeenin varastointitauti syntyy 6-fosfataasin glukoosivajeessa maksassa ja munuaisissa.
Sille on ominaista epänormaali maksan kasvu (hepatomegalia) glykogeenin ja hypoglykemian liioiteltujen kertymisen vuoksi, koska maksa ei kykene tarjoamaan glukoosia verenkiertoon. Potilailla, joilla on tämä tila, on kasvumuutoksia.
- Pompe tai tyypin II tauti johtuu a-alijäämästä (1 → 4) -glucano 6-glykosyylitransferat maksassa, sydämessä ja luurankoissa. Tämä sairaus, kuten Andersen tai tyyppi IV, on tappava ennen kahta elämää.
- McArdle tai Type V -tauti on lihasfosforylaasivaje, ja siihen liittyy lihasheikkous, vähentynyt liikuntatoleranssi, lihasglykogeenin epänormaali kertyminen ja laktaatin puuttuminen liikunnan aikana harjoituksen aikana.
Viitteet
- Bhattacharya, k. (2015). Maksan glykogeenin varastointitautien tutkiminen ja hallinta. Translaatiopiatria, 4(3), 240-248.
- Dagli, a., Lähetetty, c., & Weinstein, D. (2016). Glykogeenin varastointitauti tyyppi III. Geenikatsaukset, 1-16.
- Guyton, a., & Hall, J. (2006). Lääketieteellisen fysiologian oppikirja (11. ed.-A. Elsevier Inc.
- Mathews, c., Van Holde, K., & Ahern, k. (2000). Biokemia (3. ed.-A. San Francisco, Kalifornia: Pearson.
- McKiernan, P. (2017). Maksan glykogeenin varastointihalun patobiologia. Curr Pathebiol Rep.
- Murray, r., Taivutus, D., Botham, K., Kennelly, P., Rodwell, V., & Weil, P. (2009). Harperin kuvitettu biokemia (28. ed.-A. McGraw-Hill Medical.
- Nelson, D. Lens., & Cox, M. M. (2009). Lehninger -biokemian periaatteet. Omega -versiot (5. ed.-A.
- Rawn, j. D -d. (1998). Biokemia. Burlington, Massachusetts: Neil Patterson Publishers.
- Tarnopolsky, M. -Lla. (2018). Glykogeenimetabolian häiriöihin liittyvät myopatiat. Neuroterapeuttiset lääkkeet.
- « Argonin historia, rakenne, ominaisuudet, käytöt
- Bijektiivifunktio Mikä on, miten se tehdään, esimerkkejä, harjoituksia »

