Typpihappo (HNO2) rakenne, ominaisuudet, synteesi

- 764
- 66
- Mr. Clifford Kshlerin
Hän typpihappo Se on heikko, epäorgaanihappo, jonka kemiallinen kaava on HNO2. Se on pohjimmiltaan vesiliuoksessa, jolla on vaaleansininen väri. Se on erittäin epävakaa, ja se murtuu nopeasti typpioksidiksi, ei, ja typpihapossa, Ino3.
Se on yleensä vesiliuoksessa nitriittien muodossa. Se tulee myös luonnollisesti ilmakehästä typpioksidin reaktion seurauksena veden kanssa. Siellä, erityisesti troposfäärissä, typpihappo puuttuu otsonipitoisuuden säätelyyn.
 Typpihappoliuos dekantterilasiin. Lähde: Ei konetta luettavissa olevaa kirjailijaa. Mad Scientist ~ commonswiki oletettu (perustuu tekijänoikeusvaatimuksiin). [Julkinen verkkotunnus]
Typpihappoliuos dekantterilasiin. Lähde: Ei konetta luettavissa olevaa kirjailijaa. Mad Scientist ~ commonswiki oletettu (perustuu tekijänoikeusvaatimuksiin). [Julkinen verkkotunnus] Yläkuvassa on esitetty HNO -ratkaisu2 missä tämän hapon tyypillinen vaaleansininen väri voidaan nähdä. Se syntetisoidaan typpitrioksidin liukenemisella, n2JOMPIKUMPI3, Vedessä. Samoin se on natriumnitriittiliuosten happamoitumisen tuote alhaisissa lämpötiloissa.
Hno2 Sillä ei ole juurikaan kaupallista käyttöä käyttämällä nitriitin muodossa lihan säilyttämisessä. Toisaalta sitä käytetään atsoisten väriaineiden kehittämisessä.
Sitä käytetään yhdessä natriumtriosulfaatin kanssa potilaiden hoidossa, joilla on natriumsyanidimyrkytys. Mutta se on mutageeninen aine, ja ajatellaan, että se voi aiheuttaa substituutioita DNA -ketjujen emäksissä sytosiinin ja adeniinin oksidatiivisen deaminaation kautta.
Typpihapolla on kaksoiskäyttäytyminen, koska se voi toimia oksidatiivisena aineena tai pelkistävänä aineena; eli se voidaan pelkistää NO tai N2, hapettua3.
[TOC]
Typpihapporakenne
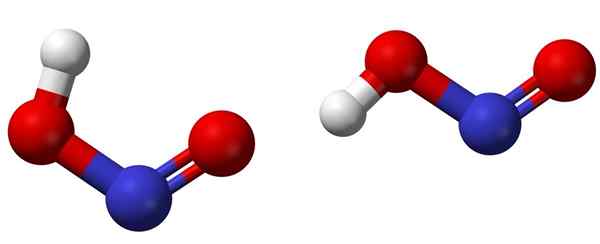 Cis (vasen) ja trans (oikea) isomeerit vastaavien HNO2: n molekyylirakenteiden kanssa. Lähde: Ben Mills [julkinen alue].
Cis (vasen) ja trans (oikea) isomeerit vastaavien HNO2: n molekyylirakenteiden kanssa. Lähde: Ben Mills [julkinen alue]. Yläkuva näyttää typpihapon molekyylirakenteen palloilla ja baarimallilla. Typpiatomi (sininen pallo) sijaitsee rakenteen keskellä muodostaen kaksoissidoksen (n = o) ja yksinkertaisen (n-o) happiatomien kanssa (punaiset pallot).
Huomaa, että vetyatomi (valkoinen pallo) on kytketty yhteen happea eikä suoraan typpelle. Joten tietäen tämän, HNO: n rakenteellinen kaava2 Se on [Ho-n = O] tai [ei (OH)], eikä tällaista H-N-linkkiä ole (kuten kemiallinen kaava voi ajatella).
Kuvamolekyylit vastaavat kaasufaasin; Vedessä niitä ympäröivät vesimolekyylit, jotka voivat hyväksyä vetyionin (heikosti) ionien muodostamiseksi2- ja h3JOMPIKUMPI+.
Voi palvella sinua: dekantterilasterinSen rakenteet voivat omaksua kaksi muotoa: cis tai trans, nimeltään geometriset isomeerit. Cis -isomeerissä H -atomi on varjossa naapurimaiden happiatomin kanssa; Vaikka trans -isomeerissä molemmat löytyvät anti -oppipate -asennoista.
Cis-isomeerissä molekyylin molekyylin (OH-ei) muodostuminen on todennäköistä, mikä voi tuoda molekyylien välistä (ONOH ONOH).
Ominaisuudet
Kemialliset nimet
-Typpihappo
-Dioxonitrihappo (III)
-Nitrosilinen hydroksidi
-Hydroksideoksidonitrogeeni (IUPAC -systemaattinen nimi)
Fyysinen kuvaus
Vaaleansininen neste, joka vastaa nitriittiliuosta.
Molekyylipaino
47 013 g/mol.
Dissosiaatiovakio
Se on heikko happo. Sen PKA on 3,35 - 25 ºC.
Sulamispiste
Tunnetaan vain liuoksessa. Siksi sulatuspistettäsi ei voida laskea, eikä kiteitä voida eristää.
Kiehumispiste
Ei ole olemassa puhdasta, vaan vedessä, tämän ominaisuuden mittaukset eivät ole tarkkoja. Toisaalta se riippuu HNO: n pitoisuudesta2, Ja toisaalta sen lämpeneminen tuottaa hajoamisen. Siksi tarkkaa kiehumispistettä ei ilmoiteta.
Myynnin muodostuminen
Liukoinen vesi -liukoiset nitriitit li+, Naa+, K -k -+, Ac2+, Herra2+, Ba2+. Mutta älä muodosta suoloja monipuolisilla kationilla, kuten:3+ ja/tai olla2+ (korkean kuormituksen tiheyden vuoksi). Se pystyy muodostamaan vakaat esterit alkoholilla.
Palopotentiaali
Se on syttyvä kemiallisille reaktioille. Voi räjähtää kosketuksella fosforitrikloridin kanssa.
Hajoaminen
Se on erittäin epävakaa yhdiste, ja vesiliuoksessa se hajoaa typpioksidissa ja typpihapossa:
2 hno2 => Ei2 + Ei +h2JOMPIKUMPI
4 hno2 => 2 hno3 + N2Tai +h2JOMPIKUMPI
Vähentävä aine
Typpihappo vesiliuoksessa on esitetty nitriitti -ionien muodossa, ei2-, jotka kokevat useita pelkistysreaktioita.
Reagoi ionien I kanssa- ja usko2+, Kaliumnitriitin muodossa typpioksidin muodostamiseksi:
2 kno2 + Ki +H2Sw4 => I2 + 2 ei +2 h2Tai +k2Sw2
Kaliumnitriitti tina -ionien läsnä ollessa pelkistetään typpioksidin muodostamiseksi:
Kno2 + 6 HCL +2 SNCL2 => 2 sncl4 + N2O +3 h2O +2 kcl
Voi palvella sinua: Beryl -hydroksidi (BE (OH) 2)Kaliumnitriitti vähenee Zn: llä emäksisessä ympäristössä, muodostaen ammoniakin:
5 h2O +kno2 + 3 Zn => NH3 + Koh +3 Zn (OH)2
Hapettava aine
Sen lisäksi, että typpihappo on pelkistävä aine, se voi puuttua hapetusprosesseihin. Esimerkiksi: hapetus rikkivetyksi, tullessa typpinä tai ammoniakkioksidiksi riippuen sen väliaineen happamuudesta, jossa reaktio tapahtuu.
2 hno2 + H2S => s +2 ei +2 h2JOMPIKUMPI
Hno2 + 3 h2S => s +nh3 + 2 h2JOMPIKUMPI
Typpihappo, happamassa pH -väliaineessa, voi hapettaa jodidi -ionin jodiin.
Hno2 + Yllyttää- + 6 h+ => 3 i2 + Nh3 + 2 h2JOMPIKUMPI
Voit myös toimia vähentäjänä CU: lla toimivana aineena2+, aiheuttaen typpihappoa.
Nimikkeistö
Hnoon2 Voit antaa muita nimiä, jotka riippuvat nimikkeistön tyypistä. Typpihappo vastaa perinteistä nimikkeistöä; dioksonihappo (III), varastossa olevalle nimikkeistölle; ja vedyn dioksonitraatti (III) systemaattisesti.
Synteesi
Typpihappo voidaan syntetisoida liuottamalla veteen typpitrioksidi:
N2JOMPIKUMPI3 + H2O => 2 hno2
Toinen valmistusmenetelmä on natriumnitriitin, nanon reaktio3, mineraalihappojen kanssa; kuten suolahappo ja bromhytihappo. Reaktio tehdään matalassa lämpötilassa ja typpihappo kulutetaan in situ.
Vanhempi veli3 + H+ => Hno2 + Naa+
H+ Se tulee joko HCL: stä tai HBR: stä.
Riskejä
Sen kemiallisten ominaisuuksien ja ominaisuuksien vuoksi HNO: n suorista myrkyllisistä vaikutuksista on vähän tietoa2. Ehkä joitain haitallisia vaikutuksia, joiden uskotaan tuottavan tämä yhdiste, johtuu tosiasiallisesti typpihappo, joka voi tapahtua hajottamalla typpihappo.
On huomautettu, että HNO2 Sillä voi olla haitallisia vaikutuksia hengitysteihin ja kyetä aiheuttamaan ärsytyksen oireita astmaattisilla potilailla.
Natriumnitriitin muodossa sitä vähenee deoksihemoglobiini, tuottaen typpioksidia. Tämä on voimakas verisuoniaine, joka tuottaa vaskulaaristen sileiden lihaksien rentoutumista, arvioimalla ihmisillä LD50 -annoksen 35 mg/kg suun kulutukseen.
Natriumnitriittien toksisuus ilmenee sydän- ja verisuonitauton romahtamisella, jota seuraa vakava hypotensio, johtuen typpioksidin verisuonia laajentavasta vaikutuksesta, joka on tuotettu nitriitistä.
Typpidioksidi, ei2, Läsnä saastuneessa ilmassa (Smog), tietyissä olosuhteissa se voi aiheuttaa typpihappoa; joka puolestaan voi reagoida amiinien kanssa muodostaakseen nitrosamiinia, karsinogeenisten yhdisteiden gammaa.
Se voi palvella sinua: hopeaoksidi (AG2O)Samanlainen reaktio tapahtuu savukkeiden savun kanssa. Tupakointiajoneuvojen sisävuoria kiinnitettyjä nitrosamiinitähteitä on löydetty.
Sovellukset
Diatsoniummyynnin tuotanto
Typpihappoa käytetään teollisuudessa diatsoniumsuolojen tuotannossa sen reaktion kautta aromaattisten amiinien ja fenolien kanssa.
Hno2 + Rnah2 + H+ => RNA = NAR +H2JOMPIKUMPI
Diatsoniumsuoloja käytetään orgaanisissa synteesireaktioissa; Esimerkiksi Sandmeyerin reaktiossa. Tässä reaktiossa tapahtuu aminohuryhmän korvaaminen (H2N-) CL-ryhmät primaarisessa aromaattisessa amiinissa-, Br- ja CN-. Näiden aromaattisten tuotteiden saamiseksi vaaditaan coupro -suoloja.
Diatsoniumsuolat voivat muodostaa loistavia kattoyhdisteitä, joita käytetään väriaineena ja toimivat myös laadullisena testinä aromaattisten amiinien läsnäolon havaitsemiseksi.
Natrium azida -eliminaatio
Typpihappoa käytetään natrium -atsidin poistamiseen3), mikä on potentiaalisesti vaarallista sen taipumuksen hyödyntämiselle.
2 Nan3 + 2 hno2 => 3 n2 + 2 ei +2 naoh
Oximas -synteesi
Typpihappo voi reagoida ketoniryhmien kanssa oksimien muodostamiseksi. Ne voidaan hapettua karboksilien tai pelkistävän hapon muodostamiseksi aiheuttamaan amiinia.
Tätä prosessia käytetään adipiinihapon kaupallisessa valmistuksessa, nylontuotannossa käytetyssä monomeerissä. Se puuttuu myös polyuretaanin tuotantoon ja sen estereihin ovat pehmittimet, pääasiassa PVC: ssä.
Sen suolaliuoksessa
Natriumnitriitin muodossa käytetään typpihappoa lihan käsittelyssä ja säilyttämisessä; Koska se estää bakteerien kasvun ja pystyy reagoimaan myoglobiinin kanssa, tuottaen tummanpunaisen värin, joka tekee lihasta houkuttelevamman kulutuksen.
Tätä samaa suolaa käytetään yhdessä natriumtiosulfaatin kanssa natriumsyanidimyrkytyksen laskimonsisäisessä käsittelyssä.
Viitteet
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. Amiini. (10th Painos.-A. Wiley Plus.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Pubchem. (2019). Typpihappo. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Sohvakoulut. (2019). Typpihappo. Palautettu: Softschools.com
- Wikipedia. (2019). Typpihappo. Haettu: vuonna.Wikipedia.org
- Kuninkaallinen kemian yhdistys. (2015). Typpihappo. Toipunut: Chemspider.com
- New World Encyclopedia. (2015). Typpihappo. Toipunut: NewWorldyClopedia.org
- Lääkekankki. (2019). Typpihappo. Toipunut: Drugbank.Ac
- Kemiallinen formulaatio. (2018). Hno2. Palautettu: quimica -formulaatio.com
- « Luvut tai indikaattorit, jotka puhuvat koulutuksen edistymisestä maassa
- Alkyylihalogenuros -ominaisuudet, saava, esimerkkejä »

