Heksaano (C6H14) Fysikaaliset ja kemialliset ominaisuudet, rakenne, käyttää, myrkyllisyyttä
- 2300
- 155
- Gustavo Runte DVM
Hän heksaani Se on hiilivety, jolle on ominaista orgaaninen yhdiste, jonka tiivistetty kemiallinen kaava on C on C on6H14. Se on väritön, läpinäkyvä neste, jota ei voida sekoittaa veden kanssa. Se esittelee viisi isomeeriä, lineaarinen on yksi teollisuuden ja tutkimuksen tärkeimmistä parafiinisista hiilivedyistä.
Heksaania saadaan raakaöljyn fraktioidulla tislauksella. Sitä esiintyy luonnollisesti myös sitrushedelmissä ja erilaisten kasvien tai hedelmien haihtuvissa fraktioissa, kuten omena, guava, paahdetut hasselpähkinät, bataatti ja salvia.
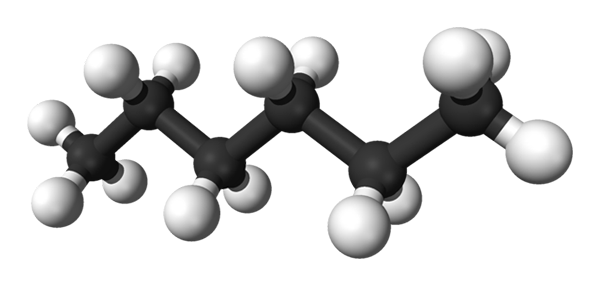
 N-heksaanimolekyyli. Lähde: Benjah-BMM27 [julkinen alue]
N-heksaanimolekyyli. Lähde: Benjah-BMM27 [julkinen alue] Se on erittäin syttyvä haihtuvaeste. Heksaania käytetään liuottimena kasviöljyjen uuttamisprosessissa, samoin kuin saastuneissa vesissä ja maaperissä olevat lipidit ja rasvat.
Ihmiset, jotka ovat ammattimaisesti altistuneet heksaanolle, voivat kokea vaurioita ääreishermostoon, joka ilmenee pistely ja jalat jaloissa ja käsivarsissa; Yleistetyn lihasheikkouden ja vakavien tapausten lisäksi luurankojen lihaksen surkastuminen.
[TOC]
Heksaanien fysikaaliset ja kemialliset ominaisuudet
Fyysinen ulkonäkö
Väritön, läpinäkyvä ja erittäin haihtuva neste.
Moolimassa
86 178 g/mol
Haju
Samanlainen bensiini
Hajukynnys
1,5 ppm
Tiheys
0,6606 g/ml
Sulamispiste
-96 --94 ºC
Kiehumispiste
68,5 - 69,1 ºC
sytytyspiste
-22 ºC (suljettu kuppi).
Vesiliukoisuus
9,5 mg/l (käytännössä sekoittumaton veden kanssa)
Liukoisuus liuottimiin
Erittäin liukoinen etanoliin, liukoinen etyylieetteriin ja kloroformiin. Sekoittuu alkoholin, kloroformin ja eetterin kanssa.
Höyryn suhteellinen tiheys ilman kanssa
2,97 (ilma = 1)
Oktanoli/vesijakokerroin
Log p = 3,764
Höyrynpaine
17,60 kPa 20 ºC: n nopeudella
Maksimaalisen optisen tiheyden aallonpituus
200 nm
Se voi palvella sinua: Niobio (NB): rakenne, ominaisuudet, käyttö, hankkiminenTaitekerroin
1 375
Goo
0,3 MPa · S
Kalorikapasiteetti
265,2 J · K-1· Mol-1
Palamislämpö
4.163,2 kj · mol-1
Höyrystyslämpö
31,56 kJ · mol-1
Pintajännitys
17,89 mn/m 25 ºC
Ionisaatiopotentiaali
10,18 eV
Vakaus
Vakaa. Yhteensopimattomia hapettavien aineiden, kloorin, fluoridin, magnesiumperkloraatin kanssa. Muodostaa räjähtävän seoksen ilmalla.
Reaktiivisuus
Heksaani voi reagoida voimakkaasti hapettavien materiaalien kanssa, joihin voi kuulua nestemäinen kloori, konsentroitu happi, natriumhypokloriitti ja kalsiumhypokloriitti. Se on myös yhteensopimattomana dyiitrogeenitroksidin kanssa. Heksaania voi hyökätä joitain muoveja, kumia ja pinnoitteita.
Heksaanirakenne
Molekyylien väliset vuorovaikutukset
Ensimmäinen kuva näyttää molekyylin n-Heksaania edustaa malli palloista ja palkkeista. Mustat pallot vastaavat hiiliatomeja, jotka säveltävät siksagging hiilirunkoa, kun taas valkoiset pallot ovat vetyatomeja. Hän n-Heksaano on siksi hiilivety, lineaarinen ja erittäin dynaaminen.
Koska kaikki sen C-H-linkit ovat alhainen napaisuus, molekyylistä puuttuu dipolimomentti. Näin toimiessaan sen molekyylien väliset vuorovaikutukset eivät ole dipolin dipolia.
Jokainen molekyyli n-Heksaano "sopii" toiseen toisen päällä erittäin alhaisissa lämpötiloissa, kuten sen oletetaan sen kiteisessä rakenteessa. Toisaalta nesteessä niiden luurankot taipuvat ja pyörivät C-H-sidoksiaan, jotka ovat peräisin siitä, että mainittu neste on haihtuva ja kiehuu 68,7 ºC: n nopeudella.
Isomeerit
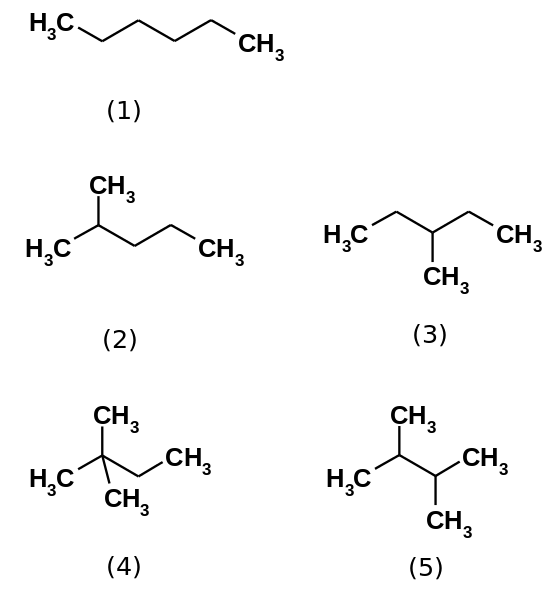 Viisi heksaani -isomeeriä. Lähde: Steffen 962 [julkinen alue]
Viisi heksaani -isomeeriä. Lähde: Steffen 962 [julkinen alue] Heksaanihiilivety koostuu viidestä isomeeristä, jotka ovat n-Heksaani vähiten haarautuneita, (1). Muut neljä isomeeriä ovat kasvavassa järjestyksessä:
2-metyylipropaani (2)
3-metyylipropaani (3)
2,2-dimetyylibutaani (4)
2,3-dimetyylibutane (5)
Huomaa, että rakenteet haarautuvat (1) - (5). Haaroittuneempien, dispergoivien voimien väheneminen, koska ei enää ole lineaarisia osia, jotka paranevat tehokkaasti. Tämä johtaa isomeerien kiehumispisteiden vähentymiseen ja variaatioon; Vaikka tiettyjä hyväksyttäviä eroja havaitaan.
Voi palvella sinua: mikä on virheeneo?Molemmat 2-metyylipropaani. Sitten sitä seuraa 2,3-dimetyylibutaani (PEB = 58 ºC), jotta lopulta sijoitetaan 2,2-dimetyylibutaani haihtuvimmaksi nesteeksi (PEB = 49,7 ºC).
Sovellukset
Heksaani sekoitetaan samanlaisten kemikaalien kanssa liuottimien tuottamiseksi. Niiden nimien joukossa, jotka nämä liuottimet saavat, ovat kaupallisia heksaania, sekoitettuja heksaaneja jne. Niitä käytetään tekstiiliteollisuuden, huonekalujen ja onttojen tulostusten puhdistusagentteina.
Heksaani on kattojen vedeneristyksessä käytetyn liiman ainesosa jalkineissa ja nahassa. Sitä käytetään myös kirjojen sitomiseen, pillereiden ja tablettien muokkaamiseen, huuhteluun, renkaisiin ja baseball -palloihin.
Heksaania käytetään mineraalien taitekerroksen ja täyttönesteen määrittämiseen lämpömittarille elohopean sijasta; Yleensä punaisella tai sinisellä väriaineella. Sitä käytetään myös rasvan ja vesiöljyn uuttamisessa sen epäpuhtauksien analysoimiseksi.
Heksaanoa käytetään liuottimena kasvinsiemenöljyn, kuten soijapavujen, rypäleiden tai bitin, uuttoon. Lisäksi sitä käytetään erilaisten alkuperien polttamiseen. Sitä käytetään alkoholin denaturoinnissa HPLC -analyysimenetelmässä ja spektrofotometriassa.
Myrkyllisyys
Hengitys ja kosketus
Heksaanin akuutti toksisuus on suhteellisen alhainen, vaikka se on lievä anestesia. Akuutti altistuminen korkealle heksaanipitoisuudelle voi tuottaa hengitystä, keskushermoston lievää masennusta (CNS), joka ilmenee huimausta, huimausta, lievää pahoinvointia ja päänsärkyä.
Voi palvella sinua: endoterminen reaktioSe voi myös aiheuttaa ihottumaa ja silmien ja kurkun ärsytystä. Krooninen heksaanin hengitys, joka liittyy työtoimintaan.
Alkuperäiset oireet ovat pistely- ja jalkakramppeja ja käsivarsia, mitä seuraa lihasheikkous. Vaikeissa tapauksissa voi olla luurankojen lihaksia sekä koordinaatio- ja näköongelmien menetys.
Heksaanin toksisuus liittyy heksaanin 25-diona-metaboliitin luomiseen. Tämä reagoi proteiinin sivuketjun aminohappo -lysiinin kanssa, mikä tuottaa proteiinitoiminnan menetyksen.
Turvallinen annos
Enviromental Protection Agency (EPA) laski vertailupitoisuuden (RFC) 0,2 mg/m heksaanille3, ja vertailunanno (RFD) 0,06 mg/kg painoa/päivä.
1960- ja 1970 -luvuilla hermojen muutosten esiintyminen. Syy oli, että he hengittivät heksaanin ilmakehässä 500 - 2.500 ppm, 8-14 tuntia päivässä.
Työntekijät esittivät heksaanon kroonisen hengityksen tunnettuja oireita, jotka löysivät lääkärit, että käsivarsien ja jalkojen lihaksia hallitsevat hermot olivat vaurioituneet.
Viitteet
- Danielle Reid. (2019). Heksaani: rakenne, kaava ja ominaisuudet. Opiskelu. Toipunut: Opiskelu.com
- Kansallinen bioteknologiatietojen keskus. (2019). Heksaani. Pubchem -tietokanta. CID = 8058. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Wikipedia. (2019). Heksaani. Haettu: vuonna.Wikipedia.org
- Molekyylien maailma. (S.F.-A. Heksaanimolekyyli. Toipunut: molekyylien maailma.com
- Kemiallinen kirja. (2017). Heksaani. Palautettu: Chemicalbook.com
- Australian liittovaltio. (S.F.-A. N-heksaani: Ristemuuriolähteet. Toipunut: NPI.Hallitus.Au
- EPA. (2000). Heksaani. [PDF]. Toipunut: EPA.Hallitus
- Myrkyllisten aineiden ja sairausrekisterin virasto. (1999). Pub-pubin terveyslausunto N-Heksanille. Haettu: Atsdr.CDC.Hallitus
- « 5 kemiallisia reaktiokokeita (yksinkertainen ja turvallinen)
- Toronjil -ominaisuudet, elinympäristö, ominaisuudet, viljely, hoito »

