Hydrolyysi mikä koostuu ja esimerkkejä reaktioista
- 4275
- 1349
- Gustavo Runte DVM
Se hydrolyysi Se on kemiallinen reaktio, jota voi esiintyä sekä epäorgaanisissa että orgaanisissa molekyyleissä tai ioneissa, ja siihen liittyy veden osallistuminen sen sidosten hajoamiseen. Hänen nimensä on peräisin kreikkalaisesta, 'vesijohto' ja rikkoutumisen 'hajotus'.
Vesimolekyyli, H2Tai se vahvistaa tasapainon happosuolojen ja heikkojen emästen ionien kanssa, jotka ilmestyvät ensimmäistä kertaa tämän käsitteen kemian ja analyyttisen kemian yleisissä tutkimuksissa. Siksi se on yksi yksinkertaisimmista kemiallisista reaktioista.
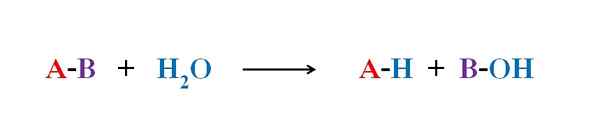 Yleinen yhtälö hydrolyysireaktiolle. Lähde: Gabriel Bolívar.
Yleinen yhtälö hydrolyysireaktiolle. Lähde: Gabriel Bolívar. Useissa esimerkeissä hydrolyysistä yksin vesi ei pysty rikkomaan tiettyä kovalenttista sidosta. Kun tämä tapahtuu, prosessi kiihtyy tai katalysoi elatusaineen happamoittamalla tai alkalisoimalla; eli H -ionien läsnäollessa3JOMPIKUMPI+ tai tai oh-, vastaavasti. On myös entsyymejä, jotka katalysoivat hydrolyysiä.
Hydrolyysi on erityinen paikka biomolekyyleissä, koska yhteydet, jotka pitävät monomeerit yhdessä, ovat alttiita hydrolysaarille tietyissä olosuhteissa. Esimerkiksi sokerit hydrolysoidaan hajottamaan polysakkaridit niiden ainesosissa glukosidaasientsyymien vaikutuksen ansiosta.
[TOC]
Mikä on hydrolyysi?
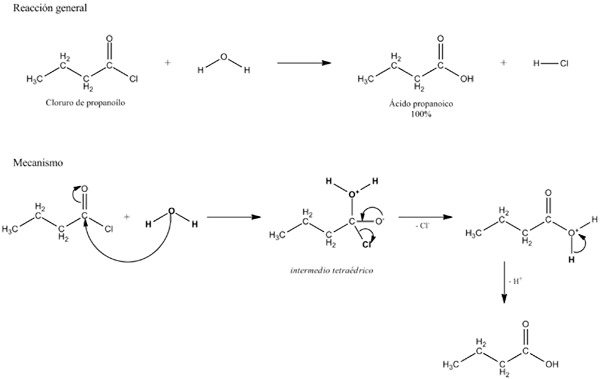
Yläkuva selittää, mistä hydrolyysi koostuu. Huomaa, että molekyyli tai substraatti (jos ne välittävät entsyymejä) katkaisee linkin, vaan myös itse veden, joka on "murtuma" H: ssa+ ja oh-, Missä H+ päättyy a ja oi- b: n kanssa. A-B reagoi vesimolekyylin kanssa, joka on peräisin kahdesta tuotteesta, A-H ja B-OH.
Hydrolyysi on siksi kondensaation vastainen reaktio. Kondensaatiossa kaksi tuotetta, sanoen A-H ja B-OH, sitovat pienen molekyylin vapauttamalla: vesi. Hydrolyysissä kulutetaan molekyyli, kun taas kondensaatiossa se vapautetaan tai tuotetaan.
Se voi palvella sinua: Karbonyyliryhmä: Ominaisuudet, ominaisuudet, nimikkeistö, reaktiivisuusPalaavat sokerien esimerkkiin oletetaan, että A-B vastaa sakkaroosidimeeriä, jossa hän edustaa glukoosia ja b fruktoosia. A-B, glukosidinen linkki voi hydrolysoitua saadakseen kaksi monosakkaridia erikseen ja liuoksessa, ja sama tapahtuu oligo- ja polysakkarideille, jos ne välittävät entsyymejä sellaisissa reaktioissa.
Huomaa, että tässä reaktiossa, A-B, nuolella on vain yksi osoite; Eli se on peruuttamaton hydrolyysi. Monet hydrolyysit ovat kuitenkin itse asiassa palautuvia reaktioita, jotka saavuttavat tasapainon.
Esimerkkejä hydrolyysireaktioista
- ATP
ATP on vakaa pH -arvojen välillä 6,8 - 7,4. Äärimmäisissä pH -arvoissa se on kuitenkin spontaanisti hydrolysoitu. Elävissä olennoissa hydrolyysi katalysoi entsyymit, jotka tunnetaan nimellä Atasas:
ATP +H2O => adp +pi
Tämä reaktio on voimakkaasti eksergonista, koska ADP: n entropia on suurempi kuin ATP: n reaktio. Gibbs -vapaa energian vaihtelu (ΔGº) on - 30,5 kJ/mol. ATP -hydrolyysin tuottamaa energiaa käytetään lukuisissa Entergon -reaktioissa.
Kytkettyjä reaktioita
Joissakin tapauksissa ATP -hydrolyysiä käytetään yhdisteen muuntamiseen yhdisteessä (b).
A +ATP +H2Tai b +adp +pi +h+
- Vettä
Kaksi vesimolekyyliä voi reagoida toisiinsa ilmeisessä hydrolyysissä:
H2Tai + h2Tai h3JOMPIKUMPI+ + vai niin-
Se on kuin yksi näistä vesimolekyyleistä murtuneet h+ ja oh-, Aion linkittää h+ Toisen vesimolekyylin happiatomiin, joka aiheuttaa hydrium -ionin, H3JOMPIKUMPI+. Tämä reaktio, enemmän kuin hydrolyysi, koskee veden omaprotolyysiä.
Voi palvella sinua: aktivointienergia- Proteiinit
Proteiinit ovat stabiileja makromolekyylejä ja niiden täydellisen hydrolyysin saavuttamiseksi niitä muodostavissa aminohapoissa vaaditaan äärimmäiset olosuhteet; kuten suolahapon (6 m) ja korkeiden lämpötilojen pitoisuus.
Elävät olennot on kuitenkin varustettu entsymaattisella arsenaalilla, jotka sallivat proteiinien hydrolyysin aminohapoissa pohjukaissuolessa. Proteiinien sulamiseen osallistuvat entsyymit erittyvät melkein kokonaan haima.
On eksopeptidaasientsyymejä, jotka hajottavat proteiineja, alkaen niiden päistä: aminopeptidaasi aminopään läpi ja karboksipeptidaasi karboksyylipään läpi. Endopeptidaasientsyymit vaikuttavat esimerkiksi proteiiniketjun sisällä: tripsiini, pepsiini, chimotripsiini jne.
- Amidas ja esterit
Amidit, kun ne lämmitetään alkalisella väliaineella, on karboksyylihappo ja amiinia:
Rconh2 + H2O => rcoo- + Nh2
Vesipitoisen väliaineen abeats hydrolysoidaan karboksyylihapossa ja alkoholissa. Prosessia katalysoi joko emäksellä tai hapolla:
Rco-or ' +h2O => rcoh +r'oh
Tämä on kuuluisa saponifikaatioreaktio.
- Happo-emäs
Vedessä useita lajeja on hydrolysoitu vesipitoisen ympäristön happamiseksi tai alkalisoimiseksi.
Perussuolan lisääminen
Natriumasetaatti, emäksinen suola, dissosioituu vedessä antaen Na -ioneja+ (natrium) ja Cho3Kujertaa- (asetaatti). Sen emäksisyys on se, että asetaatti on hydrolysoitu ionien tuottamiseksi OH-, Natrium pysyy ennallaan:
CH3Kujertaa- + H2Tai ch3COOH +OH-
Se voi palvella sinua: metyylisalisylaattiVAI NIIN- Hän on vastuussa pH: sta nousemaan ja muuttumaan perustaksi.
Happasuolan lisääminen
Ammoniumkloridi (NH4Cl) muodostuu kloridi -ionilla (CL-) suolahaposta (HCL), vahva happo ja ammoniumkationista (NH4+) ammoniumhydroksidista (NH4Voi), heikko pohja. Cl- Se ei dissosiaatio vedessä, mutta ammoniumkationi muuttuu veteen seuraavalla tavalla:
Nh4+ + H2Tai NH3 + H3JOMPIKUMPI+
Ammoniumkationin hydrolyysi tuottaa protoneja, jotka lisäävät vesipitoisen väliaineen happamuutta, joten päätellään, että NH4Cl on happasuola.
Neutraalin suolan lisääminen
Natriumkloridi (NaCl) on suolatuote voimakkaan emäksen (NaOH) reaktiosta, jolla on vahva happo (HCL). Kun veteen liukenevat natriumkloridia, tuotetaan natriumkationi (Na Na+) ja anionin (Cl--A. Molemmat ionit eivät dissosiaatio vedessä, joten ne eivät lisää H: tä+ tai tai oh-, Pidä pH -vakio.
Siksi sanotaan, että natriumkloridi on neutraali suola.
Viitteet
- Mathews, c. K -k -., Van Holde, K. JA. Ja ahern, k. G. (2002). Biokemia. (Kolmas painos). Muokata. Pearson-Addison Wesley.
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Helmestine, Anne Marie, PH.D -d. (13. tammikuuta 2019). Hydrolyysi: Määritelmä ja esimerkki. Toipunut: Admingco.com
- Theresa Phillips. (28. huhtikuuta 2019). Selitys hydrolyysiprosessista. Toipunut: Tasapaino.com
- Enyclopaedia Britannica -toimittajat. (16. marraskuuta 2016). Hydrolyysi. Encyclopædia britannica. Toipunut: Britannica.com
- Wikipedia. (2019). Hydrolyysi. Haettu: vuonna.Wikipedia.org
- « Hyrakoeriumin ominaisuudet, ravitsemus, lajit, lisääntyminen
- Alkuperäisen videopelien historia virtuaalitodellisuuteen »

