Tyydyttymättömät hiilivedyt
- 1708
- 478
- Joshua Emmerich
Selitämme, mitkä tyydyttymättömät hiilivedyt, niiden luokittelu, ominaisuudet, nimikkeistö ja annamme useita esimerkkejä
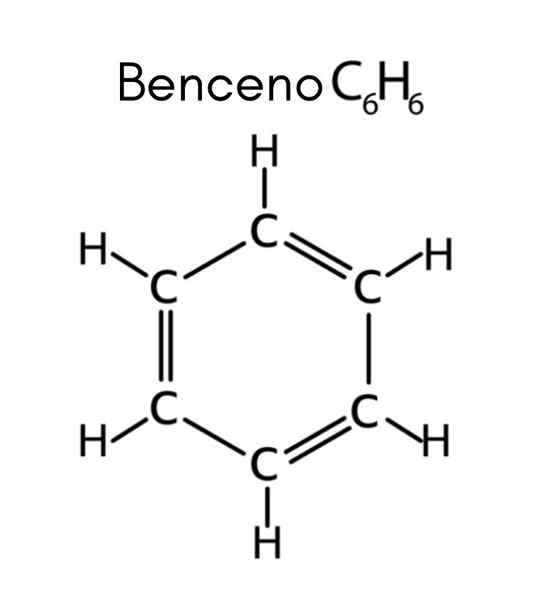
 Bentseeni on esimerkki tyydyttymättömistä hiilivetyistä
Bentseeni on esimerkki tyydyttymättömistä hiilivetyistä Mitkä ovat tyydyttymättömät hiilivedyt?
Se tyydyttymättömät hiilivedyt Ne ovat orgaanisia yhdisteitä, jotka muodostuvat vain hiilellä ja vedulla, joilla on yksi tai useampi useita sidoksia hiiliatomien välillä. Tämä tarkoittaa, että mikä tahansa kaava C -yhdistexHja joka esittelee kaksinkertaisen tai kolminkertaisen sidoksen, on tyydyttymätön hiilivety.
Tyydyttymättömät hiilivedyt muodostuvat alkeenit ja alkinit, samoin kuin aromaattiset yhdisteet. Syy, miksi he ovat tyydyttymättömiä.
Tyydyttymättömät hiilivedyt tunnistetaan sillä, että niillä on alle 2N+2 -vety (mikä on hiilen suurin hydrogeenien lukumäärä), missä n on hiiliatomien lukumäärä molekyylimuodossa.
Esimerkki tyydyttymättömistä hiilivetyistä on buteno, jonka molekyyl kaava on c4H8. 4 hiilihydronien enimmäismäärä olisi 2 (4) +2 = 10 vety. Tämä vastaa tyydyttyneen hiilivetyjen hydrogenien lukumäärää. Koska butenolla on vain 8 vettä, mikä on alle 10, niin se on tyydyttymätön hiilivety.
Tyydyttymättömyyden lukumäärä
Tyydyttymättömät hiilivedyt on ominaista tyydyttymättömyyden lukumäärä. Tämä osoittaa, että vetyparien lukumäärää vähemmän kuin tyydyttymättömiä hiilivetyjä verrataan tyydyttyneeseen, jolla on sama määrä hiiliä.
Tyydyttymättömyyden lukumäärä voidaan laskea kaikille tyydyttymättömille yhdisteille seuraavan kaavan avulla:
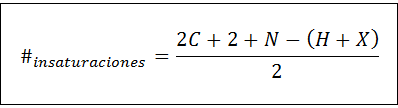
Missä C, N, H ja X edustavat hiilihiilien, nitrogeenien, hydrogeneiden ja halogeenien lukumäärää molekyylisuojassa, vastaavasti. Tämä luku antaa meille kuvan siitä, kuinka monella kaksinkertaisella tai kolminkertaisella sidoksella on yhdiste, kun otetaan huomioon sen molekyyl kaava, vaikka on huolehdittava, koska syklit (jotka eivät ole tyydyttymättömyyttä) edistävät myös tyydyttymättömyyden määrää:

Esimerkki
Bentseenillä on kaava C6H6, Joten tyydyttymättömyyden lukumäärä on:
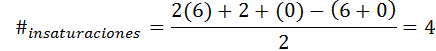
Tässä tapauksessa 4 tyydyttymättömyys vastaa kolmea kaksinkertaista linkkiä ja sykliä.
Tyydyttymättömien hiilivetyjen luokittelu
Hiilivetytyypin mukaan
- Alkeenit: He ovat niitä, joilla on ainakin yksi kaksinkertainen linkki rakenteessaan.
- Alkynes: He ovat niitä, joilla on ainakin yksi kolminkertainen linkki rakenteessaan.
- Aromaattinen: Ne ovat syklisiä monityydyttymättömiä yhdisteitä, joilla on erityisiä ominaisuuksia, jotka tekevät niistä erityisen stabiileja.
Hiiliketjun mukaan
- Lineaarinen: tyydyttymättömät yhdisteet, joissa kaikki hiiliatomit on kytketty toisiinsa yhdessä ketjussa.
- Komponentti: He ovat niitä, joilla on pääketju ja myös useita sivuttaisia ketjuja, jotka muodostavat seurauksia.
- Syklinen: Ne ovat niitä, joissa esitetään hiiliatomien suljettu sykli, jossa esitetään ainakin yksi kaksinkertainen tai kolminkertainen sidos (sykloalquenos, sykloalquinot ja aromaattiset).
Tyydyttymättömyyden lukumäärän mukaan
- Monityydyttymätön: Kun heillä on vain useita linkki, ts. Se on yksi kaksoissidos tai yksi kolminkertainen linkki.
- PolynSatylaty: Kun rakenteessa on useampi kuin yksi monilinkki, kuten Alkian, Alkian, Alkenins jne.
Tyydyttymättömien hiilivetyjen ominaisuudet
Tyydyttymättömien hiilivetyjen ominaisuudet riippuvat voimakkaasti kyseisestä hiilivetytyypistä:
Fuusio- ja kiehumispisteet
Yleensä tyydyttymättömät hiilivedyt ovat alhaiset fuusio- ja kiehumispisteet. Alkaaneihin verrattuna alkeeneilla, joilla on sama määrä hiiliä ja vastaavaa pääketjua.
Sama pätee fuusiopisteisiin. Seuraavassa taulukossa voidaan nähdä, että sekä fuusiopiste että 1-penenten kiehuminen ovat alhaisemmat kuin Pentanin ja näiden 1-Pentinon kiehut.

Fyysinen tila
Matalan sulamis- ja kiehumispisteidensä vuoksi tyydyttymättömät matalan molekyylin painokkaasti painon hiilivedyt ovat yleensä kaasumaisia huoneenlämpötilassa. Monet ovat myös nestemäisiä ja suurempi molekyylipaino on kiinteä. Monissa tapauksissa kiintoaineet ovat amorfisia kiinteitä aineita kiteisen sijasta.
Vastakkaisuus
Kaikki hiilivedyt, mukaan lukien tyydyttymättömät, ovat apolaarisia yhdisteitä, koska hiilielektronegatiivisuus ja vety ovat hyvin samanlaisia. Ainoa poikkeus on terminaalien alkinissa2 ja SP3.
Liukoisuus
Apolaariset, tyydyttymättömät hiilivedyt ovat liukenemattomia veteen ja muihin polaarisiin liuottimiin, mutta ne ovat erittäin liukoisia apolaarisiin liuottimiin, kuten hiilitetrakloridiin, sykloheksaniin ja muihin. Itse asiassa monet näistä yhdisteistä ovat sinänsä apolaarisia liuottimia.
Se voi palvella sinua: Disposio: rakenne, ominaisuudet, hankkiminen, käyttöNe ovat polttoaineita
Kaikille hiilivetyille, mukaan lukien tyydyttymättömät, on ominainen, että ne palaavat hapen läsnä ollessa hiilidioksidiksi ja veden vapauttavan energian muodossa valon ja lämmön muodossa.
He voivat polymeroida
Erilaisten kemiallisten reaktioiden kautta alkeenit ja alkinit voivat liittyä toisiinsa polymeerien muodostamiseksi, kuten polyeteenin ja polypropeenin tapauksessa mainitaan vain joitain. Joten tyydyttymättömät hiilivedyt ovat monien yleisten muovien lähtömateriaalia.
Kemiallinen reaktiivisuus
Reaktiivisuus riippuu voimakkaasti funktionaalisen ryhmän tyypistä, jolla on molekyyli. Alkeenien ja alkinien tapauksessa nämä ovat yleensä melko reaktiivisia ja voivat kärsiä hydrauksen, hydraation, hydrohalogenoinnin ja muun tyyppisten lisäysreaktioiden reaktioista.
Toisaalta aromaattiset yhdisteet ovat yleensä melko inerttejä, koska ne ovat erittäin stabiileja. Näiden yhdisteiden ominaiset reaktiot ovat aromaattisia elektrofiilisiä substituutioreaktioita.
Tyydyttymättömien hiilivetyjen nimikkeistö
Alkeenien nimikkeistö
Lineaariset alkeenit
Lineaaristen alkeenien nimi on rakennettu asettamalla etuliite, joka osoittaa ketjun hiiliatomien lukumäärän, jota seuraa hiilen paikannin, jossa erillinen kaksoissidos alkaa muun nimen skripteillä ja viimeistelty jälkiliitteellä _eno:
Etuliite
- Esimerkki:
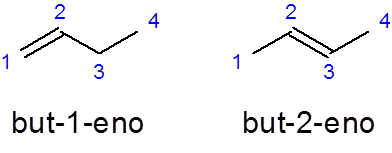
Hän But -1 -ei Se on lineaarisen butenen nimi, jossa on kaksois sidos ensimmäisessä hiilessä But-2 -yhdeksän Sillä on kaksois sidos toisessa hiilessä.
Haarautuneet alkeenit
Haaroittuneiden alkeenien tapauksessa pisin pääketju, joka sisältää molemmat kaksisidolliset hiilet. Nimi on rakennettu ensin asettamalla seuraukset aakkosjärjestyksessä, jota edeltää sen sijainti.
- Esimerkki:
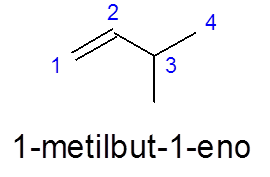
3-metyylibut-1 -En: ssä numerointi tehdään vasemmalta oikealle, jotta se olisi etusijalle kaksoissidokselle, sen sijaan, että asettaisi etusija haarautumiselle (metyyliryhmä).
Polyeenit
Monityydyttymättömien tai polenioisten alkeenien tapauksessa, jotka sisältävät useamman kuin yhden kaksoissidoksen, suurin mahdollinen kaksoissidosten lukumäärä valitaan pääketjuna riippumatta siitä, onko muita pidempiä ketjuja.
Pääketjun nimessä lisätään jokaiselle kaksoissidokselle ja etuliitteelle di, tri, tetra jne. Ennen lopettamista -ENO: ta osoittamaan kaksinkertaisten linkkien lukumäärän.
- Esimerkki:
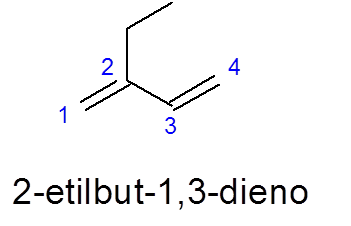
Huomaa tässä tapauksessa, että huolimatta siitä, että 5 -hiiliketju on pidempi, 4/4 on valittu, koska se sisältää kaksi kaksoislinkkiä.
Alquinosin nimikkeistö
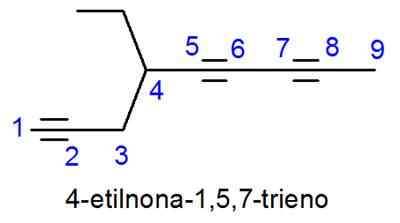
Alkynit ovat nimeltään hyvin samanlaisia kuin alkeenit, ainoa ero, että nimi päättyy -inoon -Enon sijasta. Tapauksissa, joissa on enemmän kuin yksi kolminkertainen linkki, niiden kaikkien paikannimet on sijoitettu ja numeerinen etuliite, joka osoittaa kuinka monta niitä on.
- Esimerkki:
Aromaattisten yhdisteiden nimikkeistö
Aromaattiset hiilivedyt nimitetään bentseenijohdannaisiksi, ja sekä numerointi että tapa nimetä niitä riippuu siitä, kuinka monta substituenttia renkaalla on.
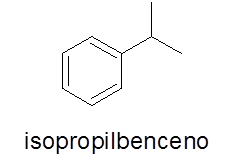
Aromaattiset renkaat yhdellä substituentilla
Tässä tapauksessa se ei ole välttämätöntä. Nimi koostuu haaran nimestä, jota seuraa sana bentseeni.
- Esimerkki:
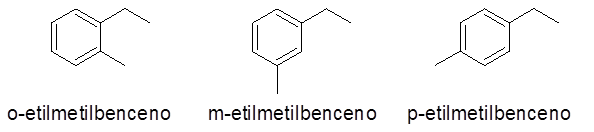
Aromaattiset renkaat, joissa on kaksi substituenttia
Tässä tapauksessa voidaan antaa 3 numeroa tai korvauskuviota (1,2), (1,3) ja (1,4). Koska on välinpitämätöntä osoittaa, mikä korvike on hiilessä 1 ja mitkä toisessa Ortho-etuliitteet (o-), meta- (m-) ja para- (p-), vastaavasti, viitata samaan.
- Esimerkkejä:
Aromaattiset renkaat, joissa on yli 2 substituenttia
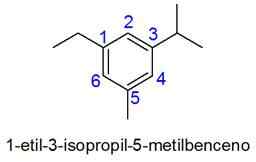
Tässä tapauksessa valitaan pienimmän paikanninyhdistelmän numerointi. Jos kaksi lukua on yhtä suuri, prioriteetti annetaan substituenteille aakkosjärjestyksen mukaan.
- Esimerkkejä:
Esimerkkejä tyydyttymättömistä hiilivedyistä
Seuraavaksi on esitetty lisäesimerkkejä tyydyttymättömistä hiilivedyistä.
Asetyleeni (C2H2-A
Asetyleeni on etinon yleinen nimi, yksinkertaisin Alchemine. Tällä yhdisteellä on 2 tyydyttymistä kolminkertaisen linkin takia, ja sitä käytetään muun muassa teräs- ja hitsauslaitteissa.
Sykloheksen (C6H10-A
6 -hiilisyklinen alkeeeni, jolla on kaksi tyydyttymistä: yksi syklin ja toisen johtuen kaksoissidoksen takia.
Venytys (c8H8-A
Tätä yhdistettä käytetään yleisesti polymeerien valmistuksessa. Se on aromaattinen alkeeeni, jolla on 5 tyydyttymätöntä.

