Alumiinihydridi (ALH3) rakenne, ominaisuudet, käyttää
- 4093
- 858
- Juan Breitenberg V
Hän Alumiinihydridi Se on epäorgaaninen yhdiste, jonka kemiallinen kaava on ALH3. Vaikka se näyttää olevan yksinkertainen luonne, se on oikeastaan hieman monimutkainen aine. Sen kiinteässä kiteisen kirkkauden takia sitä pidetään yleensä ionisena hydridinä, jonka ionit muodostuvat3+ ja h-.
Sen ominaisuudet kuitenkin osoittavat toisin: se on polymeerinen kiinteä aine, jonka uskollisin esitys olisi tyyppinen (ALH3-An, olemus n Monomeeristen yksiköiden lukumäärä Alh3 joka integroi lasiketjun tai kerroksen. Siksi Alh3 Se on yksi niistä polymeereistä, jotka onnistuvat omaksumaan kiteisen rakenteen.
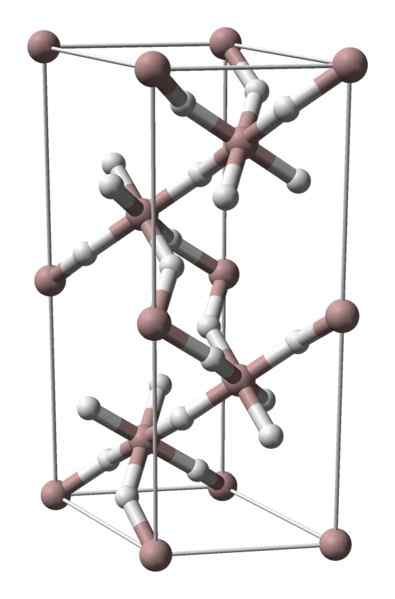 Alumiinihydridin kiteinen rakenne. Lähde: Benjah-BMM27 / julkinen verkkotunnus
Alumiinihydridin kiteinen rakenne. Lähde: Benjah-BMM27 / julkinen verkkotunnus Alumiinihydridi ei ole kiinteä, ja siinä on paljon kaupallista diffuusiota, joten käytettävissä olevat kuvat siitä on vähän. Sitä käytetään erityisesti orgaaniseen synteesiin, jossa se toimii voimakkaana pelkistävänä aineena. Se on myös erityinen paikka materiaalien teknologisessa edistyksessä, ja se on lupaava vaihtoehto vedyn varastoinnille.
Tämä yhdiste, jota kutsutaan myös Alanoksi, pitää läheisen suhteen lialhin kanssa4, joiden nimet ovat alumiini- ja litiumhydridi-, litium -alanaatti- tai litiumten tetrahydroaluminaatio. Vaikka sillä on polymeeriominaisuuksia ja lämpö metastabiilisuus, se esiintyy seitsemässä polymorfissa, joilla on erilaiset kiteiset morfologiat.
[TOC]
Rakenne
Koordinaatiot
 Alumiinikationien oktaedrinen koordinointi ALH3 -kidessä. Lähde: Benjah-BMM27 / julkinen verkkotunnus.
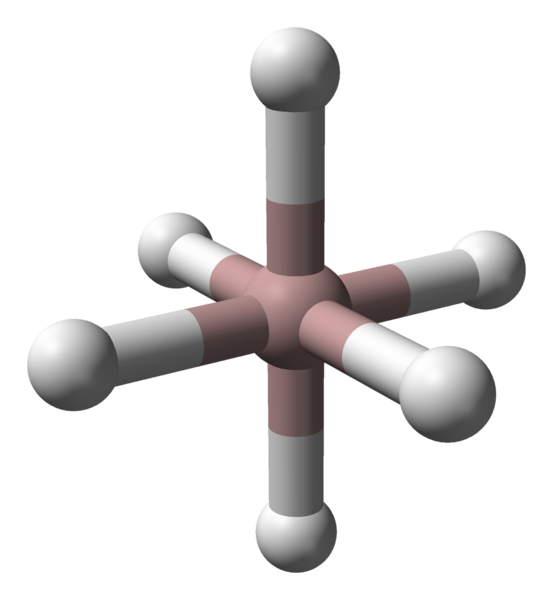
Alumiinikationien oktaedrinen koordinointi ALH3 -kidessä. Lähde: Benjah-BMM27 / julkinen verkkotunnus. Polymorfista tai tarkasteltavasta kiteisestä faasista riippumatta alumiini- ja vetyatomien välinen koordinaatio on vakio. Esimerkiksi ylemmässä kuvassa, kuten ensimmäisessä kuvassa, alumiiniatomien (ruskea pallo) koordinaatio oktaedri on esitetty ensimmäisessä kuvassa.
Voi palvella sinua: Stoikiometriset laitJokaista atomia ympäröi kuusi tuntia, mikä perustaa kuusi al-H-linkkiä. Tapa, jolla oktaedra on suunnattu avaruuteen, tekee rakenteellisen eron yhden polymorfin ja toisen välillä.
Toisaalta jokainen H-atomi koordinoitiin kahden atomin kanssa AL: n kanssa, joka muodostaa al-H-Al-sidoksen, joka voidaan perustella 3C2E-tyyppisellä linkillä (3 keskuksen 2 elektronia). Tämä linkki vastaa useiden Octaedros Alhin liittymisestä6 Koko Alano -kristallissa.
Eristetty molekyyli
Alh3 Sitä pidetään polymeerinä ALH -verkkojen takia6 jotka integroivat lasin. Yksittäisen Alano -molekyylin eristämiseksi on tarpeen kohdistaa alhaiset paineet jalokaasun inertissä ilmakehässä. Tällä tavoin polymeeri rikkoo ja vapauttaa alh -molekyylejä3 trigonaalista litteää geometriaa (analoginen BH: lle3-A.
Toisaalta on mahdollista vähentää kahta Alhia3 muodostaa a2H6, Kuten diborano, b2H6. Tämän saavuttamiseksi vaaditaan kiinteän vedyn käyttö.
Polymorfit
Alano tai Alh3 Se kykenee muodostamaan jopa seitsemän polymorfia: a, α ', β, y, Δ, ε ja ζ, joista a on stabiilin lämpötilan muutoksiin. Α-alh3 Se erotetaan siitä, että sillä on kuutiomorfologia ja kuusikulmainen kiteinen rakenne. Se on yleensä tuote, jossa muut polymorfit muuttuvat, kun ne kärsivät lämpö epävakaudesta.
Y-alh: n morfologia3, Toisaalta se erottuu neulojen tyypin olemisesta. Siksi Alh3 Kiinteä voi sisältää seoksen, jossa on enemmän kuin kahden polymorfia, ja se on monipuolinen kiteä mikroskooppiin.
Ominaisuudet
Fyysinen ulkonäkö
Alumiinihydridi on väritön tai valkeahko kiinteä, kiteinen ulkonäkö, jolla on taipumus näyttää neulamuotoja.
Voi palvella sinua: Sulfonihappo: rakenne, nimikkeistö, ominaisuudet, käytötMoolimassa
29.99 g/mol o 30 g/mol
Sulamispiste
150 ºC. Mutta se alkaa murtua 105 ° C: sta.
Vesiliukoisuus
Korkea, sitten reagoi hänen kanssaan.
Liukoisuus
Liukenematon dietyyliinnissä ja apolaarisissa liuottimissa, kuten bentseenissä ja Pentanissa. Reagoi alkoholien ja muiden polaaristen liuottimien kanssa.
Hajoaminen
Alh3 Se on alttiita hajoamisen eri nopeuksilla ulkoisista olosuhteista riippuen, niiden kiteiden morfologia ja lämpöstabiilisuus tai katalyyttien käyttö. Kun se tapahtuu, se vapauttaa vetyä ja muuttuu metallisiksi alumiiniksi:
2alh3 → 2Al + 3H2
Itse asiassa tämä hajoaminen pikemminkin kuin ongelmana on yksi syy siihen, miksi Alanoa pidetään mielenkiintoisena uuden energiateknologian kehittämisessä.
Adduktin muodostuminen
Kun Alh3 Se ei reagoi liuottimen kanssa peruuttamattomasti, se luo adduktin sen kanssa, ts. Voit esimerkiksi muodostaa kompleksin trimetyyliamiinilla, ALH3· 2n (CHO3-A3, Tetrahydrofurano, Alh3· Thf tai ruokavalion kanssa, ALH3· ET2JOMPIKUMPI. Jälkimmäinen oli tunnetuin, kun alanon synteesi tai hankkiminen otettiin käyttöön vuonna 1947.
Saada
Alh: n ensimmäiset esiintymiset3 He ovat peräisin vuosina 1942 ja 1947, kun se oli viime vuonna, kun sen synteesi esitettiin Lialhilla4 Dietyyliväliaineessa:
3Lialh4 + ALCL3+ nET -ET -2O → 4Alh3 · nET -ET -2O + 3LICL
Eteerinen liuos, Alh3 · nET -ET -2Tai hänen täytyi pettymys, tarkoituksena poistaa ET2Tai ja hanki Alh3 puhdas. Tämän ongelman lisäksi LICL olisi poistettava tuotteiden väliaineesta.
Siten vuodesta 1950–1977 uusi synteesi suunniteltiin saamaan parempia ALH -saantoja3, samoin kuin puhtaimmat kiinteät aineet ja paremmat lämpö- ja morfologiset ominaisuudet. Muokkaamalla käytettyjä määriä, vaiheita ja instrumentteja, on mahdollista suosia polymorfin saamisesta toisen yläpuolella. Kuitenkin α-alh3 Se on yleensä enemmistötuote.
Se voi palvella sinua: AliLo: Allyic Unit, Carbocation, Radical, EsimerkitMuut synteesimenetelmät koostuvat sähkökemian hyödyntämisestä. Tätä varten käytetään alumiinianodia ja platinakatodia. Anodissa seuraava reaktio ohittaa:
3alh4- + Siihen3+ + nTHF → 4AlH3 · nThf + 3e-
Katodimetalliset natriumissa saadaan. Sitten Alh3 · nTHF tapahtuu myös purkamassa THF: n poistamiseksi ja lopulta ALH: n hankkimiseksi3.
Sovellukset
Vähentävä aine
Alh3 Sen tarkoituksena on vähentää tiettyjä orgaanisten yhdisteiden funktionaalisia ryhmiä, kuten karboksyylihappoja, ketoneja, aldehydejä ja estereitä. Käytännössä se, mitä se tekee, on lisätä vetyjä. Esimerkiksi ster voidaan pelkistää alkoholiksi nitroryhmän läsnä ollessa:
 Sterin pelkistys alumiinihydridillä. Lähde: Inkivääri / julkinen verkkotunnus.
Sterin pelkistys alumiinihydridillä. Lähde: Inkivääri / julkinen verkkotunnus. Vetysäiliö
Alumiinihydridi edustaa vaihtoehtoa toimia vetysäiliönä ja siten pystyäkseen luovuttamaan sen vetyakkuilla toimiviin laitteisiin, jotka toimivat laitteisiin. H: sta saadut määrät2 vastaa suurempaa tilavuutta kaksinkertaista kuin ALH3.
ALH: n ollessa3, ja hajottaen sen hallitsemisen, tietty toivottu määrä H: tä voidaan vapauttaa2 milloin tahansa. Siksi sitä voidaan käyttää rakettipolttoaineena ja kaikkia niitä energiasovelluksia, joilla pyritään hyödyntämään vedyn palamista.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2020). Hydridi -alumiini. Haettu: vuonna.Wikipedia.org
- Kansallinen bioteknologiatietojen keskus. (2020). Hydridi -alumiini. Pubchem -tietokanta., CID = 14488. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- J -. Graetz et ai. (2011). Alumiinihydridi vety- ja energian varastointimateriaalina: menneisyys, nykyisyys ja tulevaisuus. Elsevier B.V.
- Xu Bo et ai. (2014). Opiskelijoiden hydridipolymorfien valmistus ja lämpöominaisuudet. doi.org/10.1016/j.Tyhjiö.2013.05.009
- « Lineaarinen variaatiokonsepti, esimerkit, liikunta ratkaistu
- Maanmuoto ja sen fyysiset ja tähtitieteelliset seuraukset »

