Kuparihydroksidi (II) rakenne, ominaisuudet, nimikkeistö, käyttää

- 2617
- 520
- Dr. Travis Reichert
Hän Kuparihydroksidi (II) o Kric -hydroksidi on vihertävän sininen tai sininen kiteinen epäorgaaninen kiinteä aine, jonka kemiallinen kaava on Cu (OH)2. Se saadaan sinisellä tilavuudella lisäämällä alkalinen hydroksidi kupriiliöihin (se tarkoittaa, että ne sisältävät ionit Cu2+-A. Se on epävakaa yhdiste.
Sen stabiilisuuden lisäämiseksi se valmistetaan ammoniakin läsnä ollessa (NH3) tai fosfaatit.Jos valmistellaan ammoniakin läsnä ollessa, on materiaali, jolla on hyvä stabiilisuus ja suuri hiukkaskoko.
 Kupari hydroksidinäyte, Cu (OH)2. Samzane Italian Wikipediassa [julkinen alue] Lähde: Wikipedia Commons
Kupari hydroksidinäyte, Cu (OH)2. Samzane Italian Wikipediassa [julkinen alue] Lähde: Wikipedia Commons Kun valmistelet kuparin fosfaatin (II) kanssa, Cu3(PO4-A2, Saadaan hienompi hiukkaskoko ja suurempi pinta -ala. Kupric -hydroksidia käytetään laajalti sienitautien torjunta -aineena ja bakteerisidinä maataloudessa ja puuta, pidentämällä sen käyttöikää.
Sitä käytetään myös eläinruoka -lisäravinteena. Sitä käytetään raaka -aineena muiden kuparien (II) suolojen saamiseksi ja galvanoplastisesti peittämään pintoja.
Tutkimuksia tehdään niiden potentiaalin arvioimiseksi ihmisen bakteeri- ja sieni -infektioiden torjumiseksi.
[TOC]
Rakenne
Kuparihydroksidi (II) sisältää äärettömiä kupari -ioneja (Cu2+) Yhdistynyt hydroksyyliryhmille (OH--A.
Ketjut ovat niin pakattuja, että 2 muista ketjuista peräisin olevia happiatomia on kunkin kupariatomin ylä- ja alapuolella, ja sitten käyttävät vääristyneen oktaedrisen kokoonpanon, joka on yleistä useimmissa kupariliitoksissa (II).
Rakenteessaan neljä happiatomia on 1,93 A etäisyydellä; Kaksi happiatomia on 2,63 A; Ja cu-cu-etäisyys on 2,95.
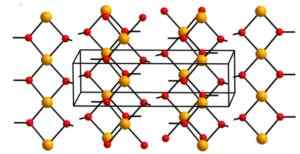 Kupri -hydroksidin kiteinen rakenne. Aleksandar Kondinski [CC BY-SA.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikipedia Commons
Kupri -hydroksidin kiteinen rakenne. Aleksandar Kondinski [CC BY-SA.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikipedia Commons Nimikkeistö
- Kuparihydroksidi (II).
- Kupikuva hydroksidi.
- Kupari -dihydroksidi.
Ominaisuudet
Fyysinen tila
Kiteinen kiinteä.
Molekyylipaino
99,58 g/mol.
Sulamispiste
Se hajoaa ennen sulamista. Hajoamispiste 229 ºC.
Voi palvella sinua: 25 esimerkkiä liukoisuudesta jokapäiväisessä elämässäTiheys
3,37 g/cm3
Liukoisuus
Se on käytännössä liukenematon veteen: 2,9 mikrogrammaa/L A 25 ºC. Nopeasti liukenevat happoihin, konsentroituneissa alkalisessa liuoksessa ja ammoniumhydroksidissa. Liukenematon orgaanisiin liuottimiin. Kuumassa vedessä se hajoaa kuparioksidin (II) tuottamisen, joka on vakaampi.
Muut ominaisuudet
Se on helposti liukoinen vahvoihin happoihin ja myös alkalisiin keskittyneisiin hydroksidiliuoksiin syvänsinisten anionien, luultavasti tyypin [Cun(VAI NIIN)2N+2-2-.
Sen vakaus riippuu valmistusmenetelmästä.
Se voidaan hajottaa antamalla kuparioksidi (II) musta (CuO), jos se pysyy levossa muutaman päivän tai matalan lämmityksen kanssa.
Ylimääräisen alkalin läsnä ollessa se hajoaa yli 50 ° C.
Sovellukset
Maataloudessa
Kuparihydroksidi (II) on laaja levitys fungisidiksi ja antibakteerisiksi maatalouskasveissa. Tässä on joitain esimerkkejä:
- Se palvelee bakteerikohteita vastaan ( Erwinia) Salaatissa levittäen lehtien kohtelua.
- Bakteeria vastaan ( Xanthomonas Pruni) Persikoissa, joihin käytetään piilevää ja lehtien käsittelyä.
- Sitä käytetään mustikoiden arkin ja varren vasten piilevien sovellusten kautta.
- Mätää Moniliinia oksikoki, piilevällä sovelluksella.
Maatalouden levittämistä varten käytetään kuparihydroksidia (II), joka valmistetaan fosfaattien läsnä ollessa sen pienen hiukkaskoon takia.
 Salaatin viljely. Lähde: Pixabay
Salaatin viljely. Lähde: Pixabay Puun säilyttämisessä
Puu orgaanisen luonteen takia on herkkä hyönteisten ja mikro -organismien hyökkäykselle. Kuparihydroksidia (II) käytetään biosideina sienille, jotka hyökkäävät puuta.
Sitä käytetään yleensä kvaternäärisen ammoniumyhdisteen vieressä (NH4+-A. Kuparihydroksidi toimii sienitautien torjunta -aineena ja kvaternäärinen ammoniumyhdiste toimii hyönteismyrkkynä.
Tällä tavoin käsitelty puu kestää tai vastustaa palveluolosuhteita ja saavuttaa käyttäjän vaaditun suorituskyvyn tason. Näillä yhdisteillä käsitellyssä puussa on kuitenkin korkea kuparitaso ja se on erittäin syövyttävä tavalliselle teräkselle, joten vaaditaan ruostumattoman teräksen tyyppistä, joka voi kestää käsiteltyyn puun käsittelyn.
Voi palvella sinua: palautuva reaktio: Ominaisuudet ja esimerkitHyödyllisyydestään huolimatta kuparihydroksidia (II) pidetään hiukan vaarallisena biosidina.
Tästä syystä on huolestuttavaa, että se vapautuu ympäristölle käsiteltystä puusta määrien määrien suhteen, jotka voivat olla haitallisia vesillä (joet, järvet, kosteikot ja meri) tai maaperän luonnollisesti läsnä oleville mikro -organismeille tai maaperästä, joka on luonnollisesti läsnä.
Rayónin valmistuksessa
Yhdeksännentoista vuosisadan jälkeen kuparihydroksidin (II) ammoniaaliliuoksia on käytetty selluloosan liuottamiseen. Tämä on yksi ensimmäisistä vaiheista saada Rayón.
Kuparihydroksidi (II) liukenee ammoniakkiliuokseen (NH3), muodostaen monimutkaisen suolan.
Lyhyet puhdistetut puuvillakuidut lisätään ammoniakkiseen kupariliuokseen, joka sisältää kuparihydroksidia (II) sakan muodossa.
Puuvillakelluloosa muodostaa kompleksin tetra-ammonium-kuparihydroksidin kanssa liukeneen liuokseen.
Myöhemmin tämä ratkaisu on Coagula kulkiessaan suulakepuristuslaitteen läpi.
Korkeiden kustannustensa vuoksi tämä tekniikka on jo voittanut Viscosan tekniikka. Bembergin tekniikkaa käytetään tällä hetkellä vain Japanissa.
Eläinruokateollisuudessa
Sitä käytetään eläinrehun jälkeinä, koska se on yksi aineista, joita tarvitaan mikroravinteina eläinten täydelliseen ravitsemukseen.
 Konsentroidut ruokia nautakarjalle. Thamizhpparithi maari [cc by-Sa 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikipedia Commons
Konsentroidut ruokia nautakarjalle. Thamizhpparithi maari [cc by-Sa 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikipedia Commons Tämä johtuu siitä, että korkeammissa elävissä olennoissa kupari on olennainen elementti, jota tarvitaan kuparia sisältävien entsyymien aktiivisuuteen.
Esimerkiksi, se sisältyy entsyymiin, joka osallistuu mm. Kollageenin tuotantoon ja entsyymiin, jota tarvitaan melaniinisynteesiin, muun muassa.
Voi palvella sinua: amiesitSe on yhdiste, joka on yleisesti tunnustettu vakuutukseksi, kun lisätään hyvän elintarvikeharjoituksen mukaisesti tasoille.
 Maitolehmä. Lähde: Pixabay
Maitolehmä. Lähde: Pixabay Muiden kupariyhdisteiden valmistuksessa (II)
Esiaste, joka on aktiivinen seuraavien kupariyhdisteiden (II) tuottamisessa: kupari (II), 2-otyyliheksanoaatti kupari (II) ja kuparisaippuat ja kuparisaippuat. Näissä tapauksissa käytetään kuparihydroksidia (II), joka syntetisoidaan ammoniakin läsnä ollessa.
Muut käyttötarkoitukset
Sitä käytetään nylonvakautuksessa akkuelektrodeissa; värikorvaamana värjäystoiminnassa; pigmentti; hyönteismyrkkyissä; paperikäsittelyssä ja värjäyksessä; katalyytteissä katalysaattorina polysulfidikumin vulkanoinnissa; anti -nostavan pigmentinä; ja elektrolyysissä, galvanoplastiassa.
Tulevat lääketieteelliset sovellukset
Kuparihydroksidi (II) on osa kupariyhdisteitä, joita tutkitaan nanohiukkasten muodossa bakteerien poistamiseksi, kuten JA. koli, K -k -. pneumoniae, p. Aeruginosa, Salmonella spp., muun muassa ihmisen sairauksien syyt.
On myös havaittu, että kuparinanohiukkaset voivat olla tehokkaita vastaan Candida albicans, Sieni, joka on yleinen syy ihmisen patologioihin.
Tämä osoittaa, että kuparinanoteknologialla voi olla tärkeä rooli bakteereja ja sieniä vastaan, jotka aiheuttavat ihmisen infektioita, ja kuparihydroksidi (II) voisi olla erittäin hyödyllinen näillä aloilla.
Viitteet
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Kirk-Othmer (1994). Kemiallisen tekniikan tietosanakirja. Osa 7. Neljäs painos. John Wiley & Sons.
- Ullmannin teollisuuskemian tietosanakirja. (1990). Viides painos. Volume A7. Vch verlagsgellschaft mbh.
- Tanssi, j.C.; Emeléus, H.J -.; Sir Ronald Nyholm ja Trotman-Deckenson,.F. (1973). Kattava epäorgaaninen kemia. Osa 3. Pergamon Press.
- Lääketieteen kansalliskirjasto. (2019). Kupari (ii) hydroksydi. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Schiopu, n. ja Tiruta-Brana, L. (2012). Puun säilöntäaineet. Puskurointimateriaalien myrkyllisyydessä. Kappale 6. ScienEdirect.com.
- Mordorski, b. ja Friedman,. (2017). Metallin nanohiukkaset mikrobi -infektiolle. Funktionalisoiduissa nanomateriaaleissa mikrobi -infektion hallintaan. Luku 4. ScienEdirect.com.
- Takashi Tsurumi. (1994). Liuos. Edistyneessä kuidun kehräystekniikassa. Luku 3. ScienEdirect.com.

