Histokemian säätiö, prosessointi, värjäys
- 4837
- 526
- Alonzo Kirlin
Se Histokemia Se on erittäin hyödyllinen työkalu eri biologisten kudosten (vihannekset ja eläimet) morfologian tutkimuksessa johtuen muun muassa kudoskomponenttien, kuten hiilihydraateista, lipideistä ja proteiineista.
Tämä arvokas työkalu mahdollistaa paitsi kudosten ja solujen koostumuksen ja rakenteen tunnistamisen, myös erilaiset reaktiot, joita näissä tapahtuu. Samoin mahdolliset kudosvauriot, jotka johtuvat mikro -organismien tai muiden patologioiden läsnäolosta.
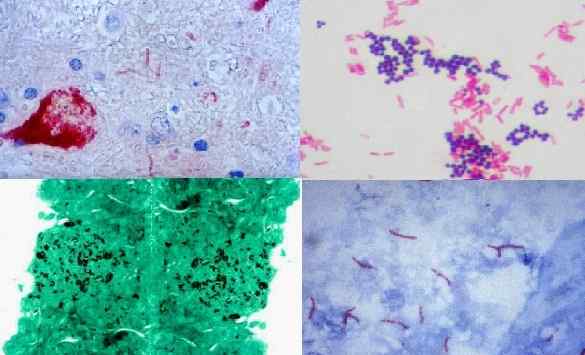
 Histokemiallinen värjäys. Niilin virus, grampositiiviset ja gram -negatiiviset bakteerit (gram), histoplasma capsulatum (grocott), mycobacterium tuberculosis (Ziehl Neelsen). Lähde: Pixinio.com/wikipedia.org/nefron [cc by-sa 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]/CDC/DR. George P. Kubica [julkinen alue]
Histokemiallinen värjäys. Niilin virus, grampositiiviset ja gram -negatiiviset bakteerit (gram), histoplasma capsulatum (grocott), mycobacterium tuberculosis (Ziehl Neelsen). Lähde: Pixinio.com/wikipedia.org/nefron [cc by-sa 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]/CDC/DR. George P. Kubica [julkinen alue] Histokemia on viime vuosisatojen ajan myötä antanut tärkeitä panoksia, kuten Paul Ehrlichin verensolujen olemassaolon osoittaminen. Tämä oli mahdollista, että Ehrlichin käyttämän kokeilueläimen aivot eivät värjätty aniliinin kanssa, mikä on perusväriaine.
Tämä johti erilaisten väriaineiden, kuten metyleenin ja indofenolin sinisen, käyttöön erityyppisten solujen värjäyttämiseksi. Tämä havainto johti solujen luokittelun happofiilisissä, basofiilisissä ja neutrofiileissä niiden spesifisen värjäyksen mukaan.
Viimeaikaiset tutkimukset ovat soveltaneet tätä tekniikkaa osoittaakseen erilaisten yhdisteiden, mukaan lukien fenolit, sekä hiilihydraatit ja ei -rakenteelliset lipidit lajien lajeissa Litsea glaucescens, tunnetuin nimellä Laurel. Näitä ovat sekä arkissa että puussa.
Samoin Colares et al, 2016, tunnisti lääkinnällisen kiinnostuksen kasvin Tarenaya Hassleriana, Histokemiallisten tekniikoiden kautta. Tässä lajissa käytiin tärkkelys, mirosina, samoin kuin fenoli- ja lipofiiliset yhdisteet.
[TOC]
Perusta
Histokemia perustuu kudoksissa olevien solurakenteiden tai molekyylien värjäytymiseen, niiden affiniteetin ansiosta spesifisillä väriaineilla. Näiden rakenteiden tai molekyylien värireaktio alkuperäisessä muodossaan visualisoidaan myöhemmin optisessa mikroskoopissa tai elektronisessa mikroskoopissa.
Värjäytymisen spesifisyys johtuu ionin hyväksyttävien ryhmien läsnäolosta, joka on läsnä soluissa tai kudosmolekyyleissä.
Lopuksi, histokemiallisten reaktioiden tavoitteena on pystyä todistamaan värityksen kautta. Suurimmista biologisista rakenteista pienimpiin kudoksiin ja soluihin. Tämä voidaan saavuttaa sen vuoksi, että väriaineet reagoivat kemiallisesti kudosten, solujen tai organelien molekyylien kanssa.
Se voi palvella sinua: mikä on mahalaukua?Syytteeseenpano
Histokemiallinen reaktio voi johtaa vaiheisiin ennen tekniikan toteutumista, kuten kudoksen kiinnitys, sisällyttäminen ja leikkaaminen. Siksi on otettava huomioon, että näissä vaiheissa voit vahingoittaa rakennetta, jonka haluat tunnistaa, heittää vääriä negatiivisia tuloksia, vaikka se olisi läsnä.
Tästä huolimatta oikein suoritetun kudoksen aikaisempi kiinnitys on tärkeää, koska hän estää autolyysin tai solujen tuhoamisen. Tätä varten.
Kudoksen sisällyttämis. Lopuksi leikkaus tehdään mikrotomilla näytteiden tutkimiseksi optisella mikroskopialla.
Lisäksi ennen kuin jatkat histokemiallisen värjäyksen suorittamista, on suositeltavaa sisällyttää ulkoiset tai sisäiset positiiviset kontrollit jokaiseen testierään. Samoin kuin tiettyjen väriaineiden käyttö rakenteiden tutkimiseen.
Histokemiallinen värjäys
Histokemiallisten tekniikoiden syntymisestä nykypäivään on käytetty laajaa väriaineita, joista yleisin käyttö, kuten Schiff (PAS), Grocott, Ziehl-Neelsen ja Gram.
Samoin muita väriaineita on käytetty harvemmin, kuten kiinalainen muste, Orcein tai Massonin trikrominen värjäys.
Schiffin periódiinihappo (PAS)
Tällä värillä voit nähdä molekyylejä, joilla on korkea hiilihydraattipitoisuus, kuten: glykogeeni ja muciini. Se on kuitenkin hyödyllinen myös mikro -organismien, kuten sienten ja loisten, tunnistamisessa. Tietyn ihon ja muiden kudosten rakenteiden (pohjamembraani) lisäksi.
Tämän värjäyksen perusta on, että väritysoksida hiilidioksidit, jotka ovat kahden lähellä olevan hydroksiliryhmän välillä. Tämä tuottaa aldehydiryhmän julkaisun, ja tämän havaitsee Schiff -reagenssi, heittämällä violetti väri.
Schiff -reagenssi koostuu emäksisestä fuchsiinista, natriummetabisulfiitista ja suolahapoista, jotka nämä komponentit ovat vastuussa purppuran värityksestä, kun aldehydiryhmiä on läsnä. Muuten muodostuu väritön happo.
Voi palvella sinua: Isomeraasi: Mikä on, toiminnot, nimikkeistö, tyypitVäritysintensiteetti riippuu monosakkarideissa läsnä olevien hydroksilli -ryhmien määrästä. Esimerkiksi sienissä, peruskalvoissa, mucinas ja glykogeenissä väri voi siirtyä punaisesta violetiksi, kun taas ytimet ovat värjättyinä sinisiksi.
Grocott
Se on yksi värjäyksistä, joka on suurin herkkyys sienten tunnistamisessa parafiiniin sisältyvissä kudoksissa. Tämä mahdollistaa eri sienirakenteiden tunnistamisen: hyfae, itiöt, endosporit, muun muassa. Siksi sitä pidetään rutiininomaisena värjäyksenä mykoosidiagnoosille.
Erityisesti sitä käytetään keuhkojen mykoosin diagnoosissa, kuten pneumosystoosissa ja aspergiloosissa Pneumocystis ja Aspergillus, vastaavasti.
Tämä liuos sisältää hopea- ja kromihappo -nitraattia, jälkimmäinen on kiinnitys ja väriaine. Perusta on, että tämä happo tuottaa hydroksiilien hapettumisen aldehydoiksi poimittuissa rakenteissa läsnä olevien mukopolysten avulla, esimerkiksi sienten soluseinämässä.
Lopuksi aldehydit hapettuu liuoksessa läsnä oleva hopea, joka aiheuttaa mustan värin, jota kutsutaan Argentafin -reaktioksi. Voit käyttää myös kontrastimerkeitä, kuten vaaleanvihreä, ja siten mustia sienirakenteita, joilla on vaaleanvihreä tausta, havaitaan.
Ziehl-Neelsen
Tämä värjäys perustuu happoalkoholiresistenssin läsnäoloon, osittain tai kokonaismäärä, joissain mikro-organismeissa, kuten genreissä Nocardia, Legionella ja Mycobacterium.
Tämän värjäyksen käyttöä suositellaan, koska aiemmin mainittujen mikro -organismien soluseinä sisältää komplekseja lipidejä, jotka estävät värityksen tunkeutumista. Etenkin hengitysteiden näytteissä.
Siinä käytetään vahvoja väriaineita, kuten fenicada fuchsiinia (emäksistä väriainetta), ja lämpöä käytetään siten, että mikro -organismi voi säilyttää väriaineen eikä vääntyä happojen ja alkoholien kanssa. Lopuksi levitetään metyleenin sininen liuos, joka on värjätty rakenteita.
Punaisissa rakenteissa havaitaan happoalkoholiresistenssin läsnäolo, kun taas rakenteet, jotka eivät kestä värjäytymistä, värjätään sinisiksi.
Gramma ja kiinalainen muste
Gram on erittäin hyödyllinen väri muun muassa bakteeri- ja sieni -infektioiden diagnosoinnissa. Tämä väritys mahdollistaa negatiivisen gramman gram -positiivisten mikro -organismien erottamisen, osoittaen selvästi erot, jotka ovat olemassa soluseinämän koostumuksessa.
Voi palvella sinua: Saponifaaltoitavat lipidit: ominaisuudet, rakenne, toiminnot, esimerkitKiinan muste on värjäys, jota käytetään vastaamaan polysakkarideja sisältäviä rakenteita (kapseli). Tämä johtuu siitä, että rengas muodostuu ympäristössä, mikä on mahdollista Cryptococcus neoformans.
Orceiini
Tämän värjäyksen kanssa värilliset ovat eri solujen elastiset kuidut ja kromosomit, mikä mahdollistaa jälkimmäisen kypsymisprosessin arvioinnin. Tästä syystä se on ollut erittäin hyödyllinen sytogeneettisissä tutkimuksissa.
Tämä perustuu väriaineen keräämiseen molekyylien negatiivisen kuormituksen avulla, kuten DNA, läsnä monien solujen keskuksissa. Joten nämä ovat värjätty sinisestä tummalle violetiksi.
Massonin trikrominen
Tätä värjäystä käytetään joidenkin mikro -organismien tai materiaalien tunnistamiseen. Näin on mykoosi, jonka aiheuttavat dematiac -sienet, ugohifomikoosit ja mustan viljan eumicetoomassa.
Viimeiset näkökohdat
Viime vuosina uusien diagnostiikkatekniikoiden luomisessa on tapahtunut monia edistyksiä, joissa histokemia on mukana, mutta liittyy muihin säätiöihin tai periaatteisiin. Nämä tekniikat pyrkivät erilaiseen tarkoitukseen, kuten immunohistokemian tai entsymohistokemian tapauksessa.
Viitteet
- Acuña U, Elguero J. Histokemia. Yksi. Kemia. 2012; 108 (2): 114-118. Saatavana osoitteessa: ovat.IQM.CSIC.On
- Mestanza r. Mikro-organismien tunnistamiseen käytettyjen PAS-, Grocott- ja Ziehl-Neelsen -histokemiallisen värjäytymisen tiheys, joka suoritetaan Eugenio Espejo Specialties Hospital -sairaalan patologisessa anatomiapalvelussa vuonna 2015. [Opinnäytetyö]. Ecuadorin keskusyliopisto, Quito; 2016. Saatavana osoitteessa: dspace.Uce.Edu
- Tapia-Torres N, De La Paz-Pérez-Olvera C, Román-Guerrero A, Quintanar-Isaías A, García-Márquez E, Cruz-Sosa F. Histokemia, kokonaisfenolipitoisuus sekä lehti- ja puun antioksidanttiaktiivisuus Litsea glaucescens Kunth (Laureaceae). Puu- ja metsät. 2014; 20 (3): 125-137. Saatavana osoitteessa: Redalycy.org
- Colares, MN, Martínez-Alonso, S, Arambarri, AM. Tarenaya Hassleriana (Cleomaceae) anatomia ja histokemia, eräänlainen lääkinnällinen kiinnostus. Latinalaisen Amerikan ja Karibian tiedotuslääketieteen ja aromaattisten kasvien 2016 tiedote; 15 (3): 182-191. Saatavana osoitteessa: Redalycy.org
- Bonifaz a. Peruslääketieteellinen mykologia. 4. painos. Meksiko: McGraw-Hill-amerikkalaisten toimittajat, S.-Lla. C: n.V. 2012.
- Silva Diego Filipe Bezerra, Santos Hellen Bandeira de Pontes, León Jorge Esquiche, Gomes Dalian. Kielen klinikan patologinen ja immunohistokemiallinen analyysi karansolujen okasolusyöpä: Harvinainen tapaus. Einstein (São Paulo) 2019; 17 (1): ERC4610. Saatavana osoitteesta: Scielo.Br
- « Hematoxylin-eosin staining characteristics, uses, techniques
- Kuparihydroksidi (II) rakenne, ominaisuudet, nimikkeistö, käyttää »

