Rautahydroksidi (II) rakenne, ominaisuudet, käyttö
- 3265
- 273
- Alonzo Kirlin
Hän Rautahydroksidi (II), Kutsutaan myös rautahydroksidiksi, se on epäorgaaninen uskon kemiallisen kaavan yhdiste (OH)2. Jos sen puhtaus on korkea, sen kiinteä koostuu vain usko -ioneista2+ ja oh- Suhteessa 2: 1; Vesimolekyylit ja erilaiset ioniset lajit voivat kuitenkin sisältää aseman muuttamisen.
Edustaa kuuluisan ruosteen "vähentynyttä" muotoa, punertavan pinnan koostettua uskon ioneista3+; Vihertävän ruosteen ollessa usko hallitsee2+, OH: n vieressä- ja toinen määrä anioneja: CO32-, Sw42-, EI3- ja halurot (f-, Cl-,… ), Esimerkiksi. Tulos, vaikka tämän vihreän ruosteen perusta on usko (OH)2, on, että saadaan erilaisia kiinteitä aineita.
 Vihreä oksidi rautapinnalla: Tämän tyyppisen hydroksidin lähdemateriaali. Lähde: Pixabay.
Vihreä oksidi rautapinnalla: Tämän tyyppisen hydroksidin lähdemateriaali. Lähde: Pixabay. Jokapäiväisessä elämässä tätä hydroksidia voidaan harkita yhteisissä paikoissa. Esimerkiksi ylemmän kuvan aluksella on peitetty vihreän ruosteen pinta (ei patina). Siellä on usko (OH)2, mutta mukana lukuisia ioneja meren aaltoja.
Kemiallisesti ottaen tämän materiaalin ominaisuudet ja käytöt riippuvat uskon kationista2+ ja hänen taipumuksensa hapettua muuttumaan uskoksi3+. Se on pelkistävä aine, joka reagoi nopeasti hapen kanssa emäksisissä olosuhteissa. Siksi sitä tulisi käyttää inertteissä ilmakehissä ja happoliuoksissa.
[TOC]
Rautahydroksidirakenne (II)
Linkit
Vain uskoa (OH)2 Puhdas, ei ole mitään enemmän usko -ioneja2+ ja oh-.
Niiden vuorovaikutuksen on oltava teoriassa ionista; Jokainen usko usko2+ houkuttelee kaksi anionia OH-, joiden suuntautumattomat nähtävyydet lopulta määrittelevät rakenteellisen ja toistuvan järjestyksen, joka määrittelee kristallin; Se puolestaan aiheuttaa vihreän ruosteen pölyä.
Se voi palvella sinua: sinkkihydroksidi (Zn (OH) 2)Ongelmana on, että molempien ionien välillä on tietty kovalenttinen luonne, ja siksi ionista Fe-OH-linkkiä ei voida sivuuttaa. Osittain ioninen Fe-OH-linkki voidaan ymmärtää, että ne on ryhmitelty eräänlaiseen polymeerikerrokseen.
Kaksoiskerrokset hydroksidia
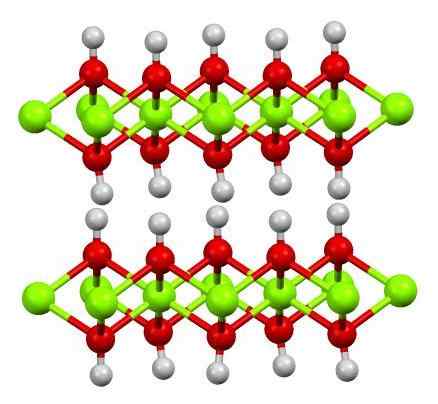
 Uskon rakenne (OH) 2. Lähde: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
Uskon rakenne (OH) 2. Lähde: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Yllä on esitetty puhtaan rautahydroksidin rakenne pallo- ja tankojen mallin kanssa. Fe -kationit2+ Niitä edustaa chillón -vihreät pallot, kun taas OH -anionit- Punaiselle ja valkoiselle alueelle. Huomaa, kuinka usko -ionit ovat linjassa2+ Kiitos vuorovaikutuksesta (ionic-kovalentista) OH: n kanssa-.
Miksi tämä rakenne on kaksoiskerrokset hydroksideja? Itse kuva tarjoaa vastauksen: OH on kaksi riviä tai kerroksia- Jokaisesta uskosta2+; eli uskon (OH) osuus 2: 1 ylläpidetään2 Mainittu alussa.
Rakenteelliset yksiköt uskon (OH)2 Ne ovat sitten näitä voileipiä, joissa kerrokset OH- He tulevat edustamaan leipää; Negatiivisesti ladattu leipä ja se ei siis pysty kiinnittämään silmiinpistävää ruskeaa kristallia.
Mutta toisaalta H: n atomit myös kohdistuvat ja pimennys toistensa kanssa. Muistaen napaisuuden ja elektronegatiivisuuden käsitteen, näillä vetyillä on pieni positiivinen osittainen kuorma, Δ+; Mikä on heikko, voi olla positiivinen alue, jolla muut anionit tai molekyylit ovat sijoitettu.
Hydraatit
Kun usko (Voi)2 Se liukenee veteen, sen molekyylit koordinoivat uskon metallikeskuksen kanssa2+ Monimutkaisen ACU: n muodostaminen: [usko (H2JOMPIKUMPI)4(VAI NIIN)2-. Tällä kompleksilla on oktaedrinen geometria kuuden ligandin kanssa: neljä vesimolekyyliä ja kaksi OH-. Rautahydroksidissa panoraama on kuitenkin hiukan erilainen.
Voi palvella sinua: Aineen säilyttämistä koskeva lakiHydraatissa, hypoteettinen kaava Fe (OH)2· NH2Tai vesimolekyylit sijaitsevat tarkalleen kahden hydroksidin kerroksen välillä; Eli he ovat vuorovaikutuksessa dipoli-ionien kautta valkoisilla vetyillä tai palloilla. Vaikuttaa siltä, että kaksi OHFEOH -ottelua tarttui ja vettä välitettiin niiden ryhmittelyyn: OHFEOH (H2O) ohfeah.
Vesimolekyylit ovat erittäin dynaamisia, estäen hydraattihiukkaset hankkimasta huomattavia kokoja ja muodostavat siten kiinteän kolloidisen tai hyytelön.
Vihreä ja punainen ruoste
Hydroksidikerroksissa on hydroksidikerrokset väliryhmiä vesimolekyylejä; Heillä voi kuitenkin olla muita anioneja (jo mainitut), aiheuttaen monenlaisia vihreitä silmiä. Ne voivat myös "saalistaa" yhtä suuria molekyylejä kuin DNA tai lääkkeitä.
Ei vain usko -ioneja voi olla läsnä2+, Mutta myös usko3+, sisäisen hapen aiheuttaman sisäisen hapettumisen tuote. Näkyvästi havaitaan, että vihreä ruoste (U -oksidi) alkaa tulla punertavaa, kun uskon pitoisuus kasvaa3+.
Ominaisuudet
 Koeputki rautahydroksidilla vedessä. Lähde: ChemicalInterest [julkinen alue]
Koeputki rautahydroksidilla vedessä. Lähde: ChemicalInterest [julkinen alue] Usko (OH) on esitetty yllä2 saostuttaa koeputkessa. Koska kompleksin ACU: n on oltava runsaasti vettä, on vallitseva vasta mainitun rakenteen yläpuolella. Huomaa, että pinta näyttää oranssilta väreiltä uskon hapettumisen seurauksena2+ uskoa3+ ilman happea; Eli tämä hydroksidi on pelkistävä aine:
Usko2+ Usko3+ + ja-
Tämän yhdisteen fysikaalinen ulkonäkö sen puhtaimmassa tilassa on ruskea kiinteä:
 Puhdas rautahydroksidi. Lähde: Ondřej Mangl [julkinen alue]
Puhdas rautahydroksidi. Lähde: Ondřej Mangl [julkinen alue] Joka sen kosteustasosta riippuen voidaan esitellä hyytelövihreänä. Se on melko liukenematon veteen (kSP= 8 · 10-16 ja liukoisuus = 0,72 g/100 ml 25ºC: ssa), ja sen molaarimassa on 89,86 g/mol ja tiheys 3,4 g/ml.
Se voi palvella sinua: 20 kemian tyyppiä ja niiden denaatiotaTämän yhdisteen kiehumis- tai fuusiopistettä ei ilmoiteta; Luultavasti johtuen siitä, että ennen lämmönlähdettä se kuivuu ja muuttuu rautaoksidiksi, ruma:
Usko (Voi)2 => Ruma + h2JOMPIKUMPI
Sovellukset
Orgaaninen laadullinen analyysi
Sen pelkistämistä käytetään nitroyhdisteiden läsnäolon, RNO: n, määrittämiseen2. Reaktio, jolle saadaan positiivinen testi, esitetään seuraavalla kemiallisella yhtälöllä:
Rno2 + 6fe (OH)2 + 4H2O => rnh2 + 6fe (OH)3
Usko (OH)3 saostuvat ruskeana -redizo -kiinteänä aineena, joka todistaa nitro -ryhmän läsnäolon, -no2.
Seleenioksoanioiden pelkistin
Uskon vähentävä voima (OH)2 Sillä on myös käytetty SEO -anionien vähentämiseen32- (Selenito) ja SEO42- (Selenaatti) Elementary -seleeniin,. Käytännössä se mahdollistaa tällaisten anionien poistamisen, jotka ovat haitallisia terveydelle, liukenemattoman ja helposti irrotettavan seleenimuokan muodossa.
Kaksikerroksiset materiaalit
Sen puhdas rakenne ja vihreä ruoste on inspiraation lähde mineralogisten ominaisuuksien uusien materiaalien suunnittelulle.
On arvioitu, että näiden funktio mahdollistaa tietyn lajin kuljetuksen kerrosten välillä siten, että sen vapautumista voidaan hallita tai pelkistää aktiiviseen kohtaan (maaperä, solut, metallipinta jne.-A.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2019). Rauta (ii) hydroksidi. Haettu: vuonna.Wikipedia.org
- Kansallinen bioteknologiatietojen keskus. (2019). Rautakadroksidi. Pubchem -tietokanta. CID = 10129897. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Nick Doe. (S.F.-A. Fenolien ja nitroryhmien testit. Kemia 211. Haettu: tutkijat.Wellesley.Edu
- Clark Jim. (27. huhtikuuta 2019). Raudan kemia. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Kingstonin tekninen ohjelmisto. (2019). Ruostekemia. Korroosiolääkärit. Palautettu: korroosiotiedot.org
- Zingaro, ralph a. et al. (1997). Oksoseleeni -anionien vähentäminen raudan (II) hydroksidilla. Ympäristö kansainvälinen. 23 (3): 299-304. Doi: 10.1016/S0160-4120 (97) 00032-9
- « Kloorioksidi (V) -ominaisuudet, rakenne, käyttää
- Kloorioksidi (III) ominaisuudet, rakenne, käyttää »

