Kloorioksidi (III) ominaisuudet, rakenne, käyttää
- 3138
- 147
- Arthur Terry II
Hän Kloorioksidi (III) Se on epäorgaaninen yhdiste, jonka kemiallinen kaava on Cl2JOMPIKUMPI3. Vastaa kloorihapon, HCLO: n anhydridiä2. Se on tummanruskea kiinteä, erittäin räjähtävä jopa lämpötiloissa, jotka ovat alle 0ºC, ja huonosti karakterisoitu. Siksi se on kiinnostunut tietokoneopinnoista.
Kemiallisesti se on kovalenttinen oksidi, joten on CL-O-sidoksia ja CL: n erillinen molekyyli2JOMPIKUMPI3 (Alempi kuva). Tämä molekyyli voi hyvinkin muodostaa HCLO: n kuivumisen2, tai alistamalla se matalalle lämpötiloille. Yksityiskohta on, että se hajoaa CL: n tuottamisen2, JOMPIKUMPI2, tai muut termodynaamisesti stabiilimmat kloorioksidit.
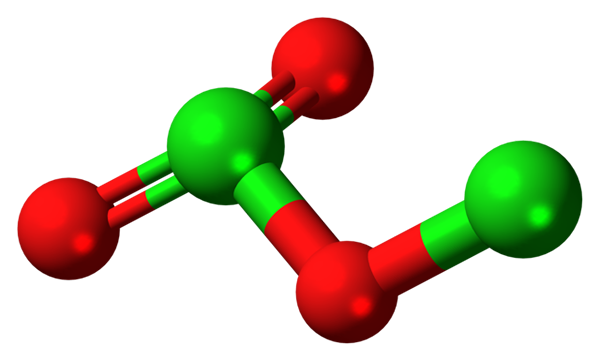
 Diklooritrioksidimolekyyli. Lähde: Jynto [CC0].
Diklooritrioksidimolekyyli. Lähde: Jynto [CC0]. Koska CL-O-joukkovelkakirjat ovat vähän polaarisia, CL-sähköposti2JOMPIKUMPI3 Siinä on pieni dipolimomentti; Siksi se ei liukene hyvin veteen tai vuorovaikutuksessa muiden polaaristen liuottimien kanssa. Sen epävakaus on sellainen, että se ei tunne kaupallisia tai potentiaalisia käyttötarkoituksia (tai räjähtävänä sen sovellettavuus olisi elinkelpoinen).
Tärkein syy sen epävakaudelle voi johtua väitetyn CL: n elektronisista ominaisuuksista3+ (Oletetaan, että puhtaasti ioninen luonne). Itse asiassa sen hapettuminen +1 ja +5 tilaa ovat stabiilimpia, kun kloori muodostaa yhdisteitä hapen kanssa.
[TOC]
Ominaisuudet
Koska sen karakterisointi on huono eikä sitä ole dokumentoitu, sen ominaisuuksista ei ole paljon sanottavaa, paitsi seuraavat kohdat:
-Sen molekyylimassa on 118 903.
-Se on vankka tummanruskea; Vaikka voit sublimoida kaasumaista klooria, sanoen kellertävät vihreät höyryt.
-Siinä puuttuu sekä kiehumis- että fuusiopiste, koska 0ºC: ssa se räjähtää (ja myös kylmemmillä lämpötiloissa).
Voi palvella sinua: dihydroksiasetonifosfaatti (DHAP): Ominaisuudet ja sovellukset-Sen liukoisuus veteen on arvioitu noin 3,42 g/100 ml, mikä todistaa, että se on matalan napaisuuden kovalenttinen molekyyli.
-Reagoi veden kanssa (vähän liukenevaa) tullakseen HCLO: ksi2-
Cl2JOMPIKUMPI3 + H2Tai 2 hclo2
Kloorioksidirakenne (III)
Kuvassa esitettiin CL: n molekyylirakenne2JOMPIKUMPI3 Palloilla ja baarimallilla. Vaikka se ei näytä paljaalta silmään, niiden alueellisten linkkien ja järjestelyjen hiljaiset vaikutukset ovat monimutkaisempia kuin miltä näyttää. Tämä rakenne vastaa yhtä monista tämän yhdisteen mahdollisista isomeereistä.
Punaiset pallot vastaavat happiatomeja ja vihreitä klooriatomeihin. Vasemmalla oleva kloori esittelee trigonaalista pyramidigeometriaa pari vapaata elektronia; Joten voidaan olettaa, että hybridisaatiosi on oltava SP3. Happiatomi toimii siltana kahden kloorin, Cl-O-Cl: n välillä.
Isomeerit
Mitkä ovat muut isomeerit? Lasketaan teoriassa yhdeksän, joista neljä on vakain (kuva mukaan lukien). Kolmella muilla olisi rakenteita, kuten:
-Clclo3. Hyvin samanlainen kuin selitetty, mutta CL-CL-linkillä.
-Clooocl (1). Tässä isomeerissä on kolmen hapen silta, joka erottaa kaksi klooriatomia (muista H: n kulmageometria2Tai visualisoida se).
-Clooocl (2). Sama hapetettu silta on läsnä myös tässä isomeerissä, lukuun ottamatta kahta klooriatomia pimennettynä avaruudessa; Yksi edessään, kun edellisessä isomeerissä he ovat kaukana.
Se voi palvella sinua: AlquinosNimikkeistö
Sen nimi, kloorioksidi (III), vastaa osoitettua osakeklaturin mukaan. Tässä oletetaan, että kloorin hapetustila on +3; Mutta se ei tarkoita, että klationi3+ Voi olla läsnä. Se on molekyyli, ei ioniverkko.
Toinen nimi, jolla CL tunnetaan myös2JOMPIKUMPI3 Se on diklooritrioksidi, systemaattisen nimikkeistön mukaan.
Ja lopullinen. Tämä nimi johtuu tosiasiasta, että kuten jo selitettiin, CL2JOMPIKUMPI3 Se tapahtuu, kun HCLO2 Se tiivistää vettä kastelua.
Sovellukset
Koska se on kloorioksidi, välitön käyttö, jota voidaan ajatella CL: lle2JOMPIKUMPI3 Se on kuin hapettava aine, joka kykenee neutraloimaan orgaanisia epäpuhtauksia ja mikrobeja. Se on kuitenkin erittäin epävakaa räjähteen lisäksi, joten tätä tarkoitusta varten sitä pidetään hyödyllisenä.
Varmasti ei ole tietoa edes siitä, kuinka CL käyttäytyy2JOMPIKUMPI3 valtavissa paineissa (jos se ei räjähtää prosessissa). Normaaliolosuhteissa se näyttää olevan vain suhteellisen stabiili ja erilainen välittäjä muiden stabiilimpien kloorioksidien keskuudessa.
Laskennallisesti se on kuitenkin tutkittu määrittämään mekanismit vapaiden radikaalien avulla, joihin liittyy useita kloorin ja hapen lajeja.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2019). Trioksididikloori. Haettu: vuonna.Wikipedia.org
- Anna hänelle l. Perry. (2011). Epäorgaanisten yhdisteiden käsikirja. (Toinen painos). CRC Press Taylor & Francis -ryhmä.
- Richard C. Roisto. (2013). Alkalisen maapallon yhdisteiden tietosanakirja. Elsevier.
- Kim K. H., Han ja.K -k -., ja lukea ja. S. (1999). Perusasetusvaikutukset CL2O3 -isomeerien stabiilisuuteen käyttämällä B3P86- ja B3LYP -tiheysmenetelmiä funktionaalista teoriaa. Journal of Molecular Structure Theochem 460 (1-3): 19-25.
- « Rautahydroksidi (II) rakenne, ominaisuudet, käyttö
- Tetrodotoksiinirakenne, ominaisuudet, käytöt, vaikutukset »

