Histidiiniominaisuudet, rakenne, toiminnot, ruoka
- 1690
- 430
- Gustavo Runte DVM
Se Histidiini (Hänen, h) se on aminohappo, jota käytetään proteiinisynteesiin. Se on hydrofiilinen molekyyli, joten se on yleensä suunnattu proteiinirakenteiden ulkopuolelle, kun ne ovat nestemäisessä väliaineessa.
Sitä pidetään välttämättömänä aminohappana kasvaville lapsille, koska he eivät tuota sitä. Aikuisella on pieni histidiinin tuotanto, mutta se ei ole riittävä päivittäisten vaatimusten toimittamiseen, joten sitä pidetään puolivälissä aminohappona.
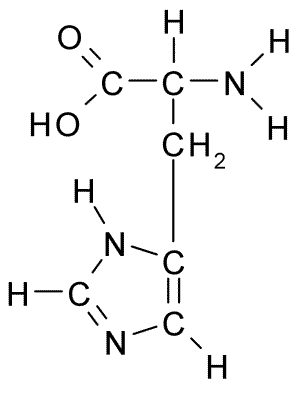
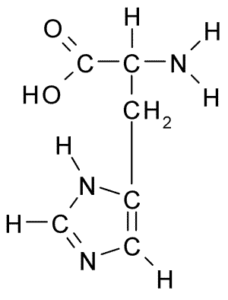 Histidiinin aminohapon kemiallinen rakenne (lähde: Borb, Wikimedia Commonsin kautta)
Histidiinin aminohapon kemiallinen rakenne (lähde: Borb, Wikimedia Commonsin kautta) Eläimille ja ihmisille histidiini on välttämätön tai ainakin puolivälissä oleva aminohappo, mutta kasvit, sienet ja mikro -organismit tuottavat tehokkaasti tarvitsemansa histidiinin ja ovat osa histidiinin ravintolähteitä, proteiinien lisäksi eläimiä.
Histidiini täyttää ihmisen erittäin tärkeät fysiologiset toiminnot, kuten: olla osa monien entsyymien aktiivisia keskuksia, jotka osallistuvat kasvuun, immuunijärjestelmään ja myeliinin muodostumiseen hermokuituissa.
Histidiinin biosynteesi on monimutkainen prosessi, joka tapahtuu pääasiassa maksassa ja vaatii 9–11 entsymaattista vaihetta. Sen hajoaminen tapahtuu maksassa ja iholla ja kulkee glutamaatin muodostumisen läpi, sitten seuraten erilaisia polkuja.
Monet elintarvikkeet ovat runsaasti histidiiniä, kuten eläinproteiineja, kuten liha- ja maitotuotteita, sekä kasviproteiineja. Nämä tarjoavat suuren osan päivittäisistä histidiinitarpeista, joita kehomme tarvitsee toimia kunnolla.
Metabolisten tai kuljetusongelmien perimisen aiheuttama alijäämä tai ylimääräinen histidiini tai saannin ruokavalion epäonnistuminen liittyvät joihinkin tärkeisiin ongelmiin, jotka vaikuttavat sekä lasten että aikuisten terveyteen. Riittävä histidiinin kulutus antaa sinun ylläpitää terveellistä ja terveellistä elämää useimmissa tapauksissa.
[TOC]
Ominaisuudet
Histidiinin korostava ominaisuus on, että se voidaan muuntaa histamiiniksi, aineeksi, joka aktiivisesti osallistuu moniin allergisiin ja tulehduksellisiin reaktioihin.
Kalassa, joka on alttiina ympäristölle ilman riittävää jäähdytystä, bakteerit voivat muuttaa histidiinin histamiiniksi, ja siksi nieltään ne aiheuttavat ruokamyrkytyksiä.
Toinen ominaisuus tälle aminohapolle on, että se on yksi harvoista olemassa olevista 22: sta, fysiologisen pH: n alueella (noin 7.4) Se on ionisoitu, ja siksi se voi aktiivisesti osallistua monien entsyymien katalyyttiseen kohtaan.
Hemoglobiinimolekyylissä proksimaalinen histidiini on yksi hemo -ryhmäligandeista. Toisin sanoen, tämä aminohappo osallistuu hemoglobiinin hapen kuljetusfunktioon ja on välttämätöntä tämän proteiinin synteesille, samoin kuin myoglobiinille, jota kutsutaan myös nimellä “lihashemoglobiini”.
Rakenne
Histidiini on aminohappo Hydrofiilinen napa- välttämätön, luokitellaan välttämättömiin aminohappoihin, koska eläimet eivät voi syntetisoida sitä. Kuitenkin ja kuten aiemmin mainittiin, bakteerit, sienet ja kasvit syntetisoivat sen.
Kasvavilla lapsilla histidiini on ehdottoman välttämätöntä; Aikuinen voi syntetisoida sen, mutta ei ole selvää, kattaako tämä histidiinin päivittäiset tarpeet, joten se on nautittava ruokavalioon.
Kuten kaikki aminohapot, histidiinillä on a -hiili, johon liittyy aminohappo, karboksyyliryhmä, vetyatomi ja sivuketju.
Voi palvella sinua: Coxiella burnetiiTämän aminohapon sivuketju muodostuu imidatsolirenkaasta, joka fysiologiseen pH: han protoneihin ja saa positiivisen kuorman ja sitä kutsutaan "Imidatsolio " lyhennettynä kuin IMH+.
Yhdessä lysiinin ja arginiinin kanssa histidiini muodostaa ryhmän emäksisiä aminohappoja. Kolmesta histidiini on vähiten emäksinen ja sen imididoólica -rengas voidaan suojata pH: lle lähellä 6.
Koska fysiologinen pH -histidiini voi vaihtaa protoneja, tämä osallistuu yleensä entsymaattiseen katalyysiin, joka sisältää protonien siirron. Lisäksi, koska se on polaarinen aminohappo, sitä löytyy yleensä proteiinien ulkopinnalta, missä se voi hydratoida vesipitoisessa väliaineessa.
Funktiot
Osana aktiivista entsyymipaikkaa
Histidiini on välttämätön monien proteiinien, erityisesti entsyymien synteesille, joiden aktiivisilla keskuksilla on tämä aminohappo. Se on osa nisäkkäiden aldlasaasien aktiivista keskustaa, missä se toimii protonin luovuttajana.
Se sijaitsee karboksipeptidaasi A: n aktiivisessa keskustassa, haiman entsyymissä, jolla on aktiivinen kohta, jonka muodostaa Zn ja Histidine. Glykolittisessä entsyymissä mutasa -fosfoglyktiona on aktiivisessa keskuksessa kaksi histidiinijätettä, jotka toimivat fosforyyliryhmien vastaanottajina tai luovuttajina.
Sitä löytyy myös entsyymien aktiivisesta kohdasta, kuten glyseraldehydi 3-fosfaattidehydrogenaasi, laktaattidehydrogenaasi, papaiini, kimotripsiini, rnasa a ja ammoniakki liasa histidiini (histidaasi). Lisäksi se on entsyymin glutamiinisyntetaasin estäjä.
Muut toiminnot
Tällä aminohapolla on suuri merkitys organismille, koska sen dekarboksylaasihistidiinivarasto.
Histidiiniä tuotetaan keskushermostoneuroneilla, joilla on neuromodulatoisia toimintoja.
Se on välttämätöntä hermokuitujen myeliinipodien muodostumiseksi, joten se täyttää tärkeän roolin niiden sähköisissä impulssien siirrossa.
Yhdessä kasvuhormonin ja muiden aminohappojen kanssa histidiini myötävaikuttaa kudoksen korjausmekanismeihin, pääasiassa sydän- ja verisuonijärjestelmässä.
Joitakin lisätoimintoja ovat:
- Myötävaikuttaa joidenkin raskasmetallien vieroitus.
- Suojaa säteilyn aiheuttamilta vaurioilta.
- Osallistu punaisten ja valkosolujen muodostumiseen.
- Se on välttämätöntä hemoglobiinin muodostumiselle.
- Se auttaa torjumaan nivelreuman joitain kielteisiä vaikutuksia, kuten tulehduksia ja liikkuvuuden puutetta.
- Se on tärkeä aminohappo kapillaarien uudistamiselle, kasvulle ja seksuaaliselle toiminnalle.
Karnosiini, anseriini ja homokosiini ovat dipéptidejä, jotka on muodostettu histidiinistä. Kaksi ensimmäistä löytyy lihaksista, ja niillä on tärkeitä toimintoja, kuten tamponereita ja myosiinin aktivaattoreita.
Homokosiinia tuotetaan aivoissa määrän 100 kertaa suurempi kuin luurankojen lihasten lihallinen.
Biosynteesi
Histidiini saa hiilihapotetun luurankon 5-fosfaattiriboosista. Bakteereissa JA. Koli, Tämä aminohappo tapahtuu mainitusta yhdisteestä 11 entsymaattisen vaiheen avulla:
- Synteesin ensimmäinen vaihe koostuu fosforribosyylin siirrosta ATP: stä 5-fosfaattiriboosin hiili 1: een tuottaen 5-fosforribosyyli-1-pyrofosfaatin (PRPP) (PRPP) (PRPP) (PRPP) (PRPP). Fosforribosyyli-pyrofosfaattisyntetaasi (PRPP-syntetaasi) entsyymi katalysoi tätä reaktiota.
- Sitten hiilipyrofosfaattiryhmän 1 siirto ATP: n N-1: een tapahtuu, ja N1-esiintyminen (5'-fosforribosyyli) -ATP. Tätä reaktiota katalysoi entsyymi on ATP -fosforieltransferaasi.
- Fosforribosyyli-top-pyrofosfaattihydroksylaasin vaikutuksella a-pyfosfaattihydroksylaasi ATP: n β-pyofosfaattiryhmä on hydroksilaasi ja muodostuu N1- (5'-fosforribosyyli) -amp.
- Fosforibosyylikarttaentsyymi-hydroksylaasi avaa puriinirenkaan N-1: n ja C-6: n ja ribonukleotidin välillä N1- (5'-fosforriilformimino) -5-aminoimidatsoli-4-Carboksamid-1-likuloketoidea.
- Sitten Ribofuranosa-rengas, joka tulee PRPP: stä, avataan ja isomeroituu ketosaan muodostaen N1- (5'-fosforribosyyliformiini) -5-aminoimidatsoli-4-karboksamidi-1-lribonukleotidi isomeraasin entsyymin voimassa.
- Aminotransferaasientsyymi siirtää glutamaatin glutamiiniryhmän, josta tulee glutamaatti, ja rikkoo formiinilinkin, joten se vapautuu 5-aminoimidatsolikarboksamidi-1-lribonukleotidi ja imidatsol-glyserolifosfaatti syntyy.
- Imidatsoli-glyserolifosfaatin vesimolekyyli eliminoidaan imidatsoli-glyserolifosfaatti-dehydraasin avulla ja muodostaa imidatsoliasetolin fosfaatin.
- Imidatsoli-asetoolifosfaatti siirretään aminohuryhmä histidinolitransaminaasifosfaatin kautta ja muodostuu fosfaatti-histidinoli.
- Histidinolifosfaatin fosforiesteriryhmä histidinolin muodostamiseksi hydrolysoidaan. Histidinolifosfaatti fospaasi katalysoi tätä reaktiota.
- Myöhemmin histidinolia hapettuu histidinolidehydrogenaasilla ja on histidinal.
- Sama histidinolidehydrogenaasi hapettuu histidinaaliksi ja tekee siitä histidiinin.
Histidiinin biosynteettisen reitin ensimmäinen entsyymi estää reitin tuote, toisin sanoen histidiini osallistuu ATP -fosforibosyylitransferaasin alestriseen estämiseen, joka edustaa reitin päämekanismia reitin säätelyn päämekanismia.
Heikkeneminen
Histidiini, proliini, glutamaatti, arginiini ja glutamiini ovat aminohappoja, jotka lopulta muodostuvat a-zotogluraatin muodostavat. Neljästä heistä tulee ensin glutamaattia, joka transaminaation takia aiheuttaa α-ketogluttoida.
Histidiini histidinaasin kautta menettää a-amino-ryhmän tullakseen Urocanatoksi. Sitten urokanaasi kosteuttaa Urocanato-asemaa 1 ja 4 muodostaen 4-midatsoloni-5-propionaatin. Myöhemmin esiintyy 4-midatsoloni-5-propionaton imino-ryhmä, joka muodostaa N-formiminoglutamaton.
Viimeinen reaktio merkitsee formyylin siirtämistä N-formiminoglutamaatista tetrahydrofolaatiksi, joka toimii entsyymin glutamaatin formimaalisen siirron kanssa. Tämän reaktion lopputuotteet ovat glutamaatti- ja n5-formimino-tetrahydrofolaatti.
Α-ketoglutaraatti muodostuu glutamaatin transaminaatiolla. Α-ketoglutaraatti on Krebs-syklin välittäjä ja voi myös päästä glukoneogeeniseen reittiin glukoosin muodostumiseen.
Glutamato -amino -ryhmä tulee virtsan eliminoimaan urean tuotantosyklin. Kaikki nämä reaktiot tapahtuvat maksassa ja osa niistä iholla.
Ruokia, joissa on runsaasti histidiiniä
Päivittäiset histidiinitarpeet ovat noin 10–11 mg / kg ruumiinpainoa päivässä. Kasvavilla lapsilla histidiini on välttämätön aminohappo, joka on toimitettava ruokavalion mukana.
Muissa eläimissä histidiini on myös välttämätön aminohappo, ja stableissa kasvatettujen tulisi saada histidiiniä normaalin hemoglobiinitason ylläpitämiseksi.
Histidiinirikkaiden elintarvikkeiden joukossa ovat:
- Naudanliha, lammas, sianliha, kana ja kalkkuna. Sitä löytyy myös kaloista, kuten tonnikala (jopa purkitettujen), lohen, taimenen, pargon ja Lubinan sekä joissain merenelävissä.
Voi palvella sinua: Veriviljely: Mihin se on, perusta, menettely, tulokset- Maito ja sen johdannaiset, etenkin kypsytetyissä juustoissa, kuten parmesan, gruyere, sveitsiläinen juusto, gouda, muun muassa. Alkuperäiskansoissa, seerumissa, jogurtissa ja smetanassa.
- Soijapavut ja pähkinät, kuten pähkinät ja siemenet. Auringonkukka, kurpitsa, vesimeloni, seesami, mantelit, pistaasi, maapähkinävoi ja chia.
- Munat ja pavut tai valkoiset pavut.
- Koko jyvät, kuten quinoa, vehnä, kiinteä riisi jne.
Saannisi edut
On olemassa useita patologisia tiloja, joissa histidiini voi olla hyödyllinen hoidon adjuvanttina.
Näistä patologioista voimme nimetä nivelreuman, valtimoiden verenpainetaudin (koska histidiinin hypotensiivinen vaikutus on kuvattu) infektioissa, jäykkyydessä ja sukupuolessa ja kuuloissa, haavauteissa ja anemioissa.
Iholla kulutetun histidiinin hajoaminen tuottaa urokaanihappoa, joka pystyy suojaamaan ihoa, koska se imee ultraviolettisäteet.
Terveiden yksilöiden ylimääräinen kulutus ei tuota suuria muutoksia, koska se on nopeasti hajotettu. Histidiinin ruokavalion käyttöä potilailla, joilla on vaikea maksa ja/tai munuaisongelmat, tulisi kuitenkin rajoittaa.
Puutoshäiriöt
Histidiinin alijäämä liittyy immuunivasteen muutoksiin.
Histidiinivajeeseen liittyvät luuongelmat, kuurous ja anemiat on myös raportoitu.
Hartnupin tauti on perinnöllinen tila, joka vaikuttaa histidiinin ja tryptofaanin kuljetukseen ohuen suolen ja munuaisten limakalvon läpi, mikä aiheuttaa molempien aminohappojen alijäämän.
Merkittävimmät kliiniset oireet ovat ihon scrugous- ja punaisten leesioiden esiintyminen auringon altistumisen jälkeen, erilaiset liikkumisen muutokset ja joitain psykiatristen sairauksien oireita.
Histidinemia on autosominen recessiivinen sairaus, jolle on ominaista histidaasientsyymin alijäämä, joka aiheuttaa veren ja virtsan histidiinipitoisuuksien lisääntymisen.
Seurauksena on, että nämä potilaat eivät voi hajottaa histidiiniä urokaalihapoksi maksassa ja iholla. Tähän sairauteen liittyy kohtalainen henkinen vajaatoiminta, puhevauriot ja kuulo muisti ilman kuuroa.
Histidiinin saannin rajoittaminen hoidona ei ole ollut tehokasta kliinisen parantamisen tuottamisessa ja siihen liittyy riski kasvuhäiriöiden aiheuttamisessa lapsilla, joihin tämä tauti kärsii.
Viitteet
- Mathews, c., Van Holde, K., & Ahern, k. (2000). Biokemia (3. ed.-A. San Francisco, Kalifornia: Pearson.
- Murray, r., Taivutus, D., Botham, K., Kennelly, P., Rodwell, V., & Weil, P. (2009). Harperin kuvitettu biokemia (28. ed.-A. McGraw-Hill Medical.
- Nelson, D. Lens., & Cox, M. M. (2009). Lehninger -biokemian periaatteet. Omega -versiot (5. ed.-A. doi.org
- Perecarz, p., Farri, l., & Papageorgiou, a. (1983). Ihmisen maidon ja matalan proteiinin kaavojen vaikutukset kehon kokonaisproteiinin siirtymän ja virtsan 3-metyylihistidiinin erittymiseen ennenaikaisten imeväisten erittyminen. Kliininen tiede, 64, 611-616.
- Laulu, b. C., Joo, n., Aldini, G., & Yeum, k. (2014). Histidiini-dipeptidien ja metabolisen oireyhtymän biologinen toiminta. Ravitsemustutkimus ja käytäntö, 8(1), 3-10.
- « Happea ominaisuudet, rakenne, riskit, käyttää
- Asiantuntijajärjestelmien historia, ominaisuudet, edut, haitat »

