Happea ominaisuudet, rakenne, riskit, käyttää

- 2667
- 132
- Joshua Emmerich
Hän happi Se on kemiallinen elementti, jota edustaa symboli tai. Se on erittäin reaktiivinen kaasu, joka johtaa ryhmää 16: Calcogens. Tämä nimi johtuu siitä, että rikki ja happi ovat läsnä melkein kaikissa mineraaleissa.
Sen korkea elektronegatiivisuus selittää sen suuren aviditeetin elektronien avulla, mikä johtaa yhdistymään suureen määrään elementtejä; Näin syntyy laaja valikoima mineraalioksideja, jotka rikastuttavat maan kuorta. Siten jäljellä oleva happi säveltää ja tekee ilmakehästä hengittävän.
 Happi on yleensä synonyymi ilmalle ja vedelle, mutta sitä löytyy myös kivistä ja mineraaleista. Lähde: Pxhere.
Happi on yleensä synonyymi ilmalle ja vedelle, mutta sitä löytyy myös kivistä ja mineraaleista. Lähde: Pxhere. Happi on kolmas runsauden elementti maailmankaikkeudessa, vedyn ja heliumin takana, ja se on myös Maan aivokuoren tärkein massan aineosa. Sen tilavuusprosentti on 20,8% maan ilmakehästä, ja se edustaa 89% vesimassasta.
Sillä on yleensä kaksi allotrooppista muotoa: Diatominen happi (tai2), mikä on luonteeltaan yleisin tapa ja otsoni (tai3), löydetty stratosfääristä. Kuitenkin on kaksi muuta (tai4 Minä8) se on sen nestemäisessä tai kiinteässä vaiheessa ja valtavissa paineissa.
Happea tuotetaan jatkuvasti fotosynteesiprosessin kautta, jonka suorittavat kasviplanktonit ja maanpäälliset kasvit. Tuottamisen jälkeen se vapautetaan siten, että elävät olennot voivat käyttää sitä, kun taas pieni osa siitä liukenee merelle, tukee vesielämää.
Siksi se on olennainen osa eläviä olentoja; Ei vain siksi, että sitä esiintyy useimmissa niiden muodostavissa yhdisteissä ja molekyyleissä, vaan myös puuttuvat kaikissa metabolisissa prosesseissaan.
Vaikka kiistanalaisesti sen eristyminen johtuu Carl Scheelesta ja Joseph Priestleystä vuonna 1774, on viitteitä siitä, että happi oli todella eristetty ensimmäistä kertaa vuonna 1608, kirjoittanut Michael Sevenvogius.
Tätä kaasua käytetään lääketieteellisessä käytännössä parantaakseen hengitysvaikeuksia kärsivien potilaiden elinoloja. Samoin happea käytetään sallimaan ihmiset toteuttaa toimintojensa ympäristöissä, joissa ilmakehän happea on vähentynyt tai ei ole pääsyä.
Kaupallisesti tuotettua happea käytetään pääasiassa metallurgisessa teollisuudessa raudan muuntamiseksi teräkseksi.
[TOC]
Historia
Nitroariaalinen henki
Vuonna 1500 Leonardo da Vinci, joka perustuu toisella vuosisadalla Philo de Bysantiumin kokeisiin. C., Hän päätteli, että osa ilmasta kulutettiin palamisen ja hengityksen aikana.
Vuonna 1608 Cornelius Drebble osoitti, että lämmityshuone (hopea nitraatti, kno3) Tapahtui kaasua. Tämä kaasu, kuten myöhemmin tiedetään, oli happea; Mutta Drebble ei pystynyt tunnistamaan sitä uudeksi elementiksi.
Sitten, vuonna 1668, John Majow huomautti, että osa ilmasta, jota hän kutsui "Spiritus nitroaerus", oli vastuussa tulipalosta ja että se kulutettiin myös hengityksen ja aineiden palamisen aikana. Mavow havaitsi, että aineet eivät järjestäneet nitroarial hengen puuttumista.
Majoow suoritti antimonin palamisen ja havaitsi antimonin painon nousun palamisen aikana. Sitten Mavow päätteli, että antimoni yhdistettynä nitroariaaliseen hengeen.
Löytö
Vaikka hän ei saanut tunnustusta tiedeyhteisöltä, elämässä tai kuolemansa jälkeen, Michael Sandivogius (1604) on todennäköisesti happea havaitsija.
Sandivogius oli alkemisti, filosofi ja ruotsalainen lääkäri, joka tuotti kaliumnitraatin lämpöhajoamisen. Hänen kokeilunsa johtivat hänet hapen vapauttamiseen, jota hän kutsui "Cibus Vitae": Elämän ruoka.
Vuosina 1771 - 1772 ruotsalainen kemisti Carl W Scheele lämmitti useita yhdisteitä: kaliumnitraatti, mangaanioksidi ja elohopeaoksidi. Scheele havaitsi, että heiltä vapautettiin kaasua, joka lisäsi palamista ja johon hän kutsui "palo ilma".
Joseph Priestly -kokeet
Vuonna 1774 englantilainen kemisti Josephin papillisesti lämmitetty elohopeaoksidi käyttämällä 12 -tuumaista lisäosaa, joka keskittyi auringonvaloon. Elohopeaoksidi vapautti kaasun, joka aiheutti kynttilän palaneen paljon nopeammin kuin normaalia.
Lisäksi paply testasi kaasun biologista vaikutusta. Tätä varten hän asetti suljettuun astiaan hiiren, jonka hän odotti selviävän viisitoista minuuttia; Kaasun läsnä ollessa hän selvisi tunnissa enemmän kuin arvioi.
Priestly julkaisi tuloksensa vuonna 1774; Kun Scheele teki sen vuonna 1775. Tästä syystä hapen löytäminen papille johtuu yleensä.
Happi ilmassa
Antoine Lavoisier, ranskalainen kemisti (1777), huomasi, että ilma sisältää 20% happea ja että kun aine palaa, se todella yhdistyy happea.
Lavoisier päätteli, että ilmeinen painonnousu, jonka palamisen aikana kokeneet aineet johtuivat ilmassa tapahtuvasta painonpudotuksesta; Koska happi yhdistettynä näihin aineisiin ja siksi reagenssien massot säilytettiin.
Tämä antoi Lavoisierille mahdollisuuden laatia aineen säilyttämislaki. Lavoisier ehdotti hapen nimeä, joka tuli juuresta "Oxys" ja "geenit" muodostuminen. Sitten happi tarkoittaa 'happea entinen'.
Tämä nimi on väärä, koska kaikki hapot eivät sisällä happea; Esimerkiksi vety halogeenidit (HF, HCL, HBR ja HI).
Dalton (1810) osoitti vedelle kemiallisen kaavan Ho: n ja siksi hapen atomipaino oli 8. Ryhmä kemikaaleja, mukaan lukien Davy (1812) ja Berzelius (1814) korjasi Daltonin lähestymistavan ja päätteli, että veden oikea kaava on H2O ja hapen atomipaino on 16.
Voi palvella sinua: Disionisoitu vesiFysikaaliset ja kemialliset ominaisuudet
Ulkomuoto
Väritön, wc ja mauton kaasu; Vaikka otsonilla on hehtaarin haju. Happi suosii palamista, mutta se sinänsä se ei ole polttoaine.
 Nestemäinen happi. Lähde: Staff Sgt. Nika Glover, u.S. Ilmavoimat [julkinen alue]
Nestemäinen happi. Lähde: Staff Sgt. Nika Glover, u.S. Ilmavoimat [julkinen alue] Nestemäisessä muodossaan (ylempi kuva) se on vaaleansininen ja sen kiteet ovat myös sinertäviä; Mutta he voivat hankkia vaaleanpunaisia, oransseja ja jopa punertavia sävyjä (kuten rakenteensa osassa selitetään).
Atomipaino
15 999 U.
Atominumero (z)
8.
Sulamispiste
-218,79 ºC.
Kiehumispiste
-182 962 ºC.
Tiheys
Normaaleissa olosuhteissa: 1 429 g/l. Happi on tihein kaasu kuin ilma. Lisäksi se on huono lämmön ja sähköjohdin. Ja kiehumispisteessä (neste) tiheys on 1 141 g/ml.
Kolminkertainen
54 361 K ja 0,1463 kPa (14,44 atm).
Kriittinen piste
154 581 K ja 5 043 MPa (49770,54 atm).
Sulamislämpö
0,444 kJ/mol.
Höyrystyslämpö
6,82 kJ/mol.
Molaarinen kalorikapasiteetti
29 378 J/(mol · k).
Höyrynpaine
90 K: n lämpötilassa höyrypaine on 986,92 atm.
Hapetustilat
-2, -1, +1, +2. Tärkein hapettumistila on -2 (tai2--A.
Elektronegatiivisuus
3.44 Pauling -asteikolla
Ionisaatioenergia
Ensimmäinen: 1.313,9 kJ/mol.
Toiseksi: 3.388,3 kJ/mol.
Kolmas: 5.300,5 kJ/mol.
Magneettinen järjestys
Paragneettinen.
Vesiliukoisuus
Veden hapen liukoisuus laskee lämpötilan noustessa. Esimerkiksi: 14,6 ml happea/l vettä liuotetaan 0 ºC: iin ja 7,6 ml happea/l vettä 20 ºC: n lämpötilassa. Hapen liukoisuus juomaveteen on suurempi kuin merivedessä.
Lämpötilaolosuhteissa 25 ºC ja paineessa 101,3 kPa juomavesi voi sisältää 6,04 ml happea/l vettä; Kun taas meriveden vesi vain 4,95 ml happea/l vettä.
Reaktiivisuus
Happi on erittäin reaktiivinen kaasu, joka reagoi suoraan melkein kaikkien elementtien kanssa huoneenlämpötilassa ja korkeissa lämpötiloissa; lukuun ottamatta metalleja, joilla on suurempi pelkistyspotentiaali kuin kupari.
Voit myös reagoida yhdisteiden kanssa, hapettaa niissä olevat elementit. Näin tapahtuu, kun se reagoi esimerkiksi glukoosin kanssa veden ja hiilidioksidin tuottamiseksi; tai kun puu tai hiilivety palaa.
Happi voi hyväksyä elektronit täydellisellä tai osittaisella siirtolla, joten sitä pidetään hapettavana aineena.
Yleisin hapettumisnumero tai hapettumistila on -2. Tällä hapettumisnumerolla sitä löytyy vedestä (H2O), rikidioksidi (niin2) ja hiilidioksidi (CO2-A.
Myös orgaanisissa yhdisteissä, kuten aldehydeissä, alkoholissa, karboksyylihapoissa; Yleiset hapot, kuten h2Sw4, H2Yhteistyö3, Hno3; ja sen johdettuissa suoloissa: NA2Sw4, Naa2Yhteistyö3 OK ei3. Kaikissa niissä O: n olemassaolo voitaisiin olettaa2- (mikä ei pidä totta orgaanisiin yhdisteisiin).
Oksidit
Happea on läsnä tai2- Metallioksidien kiteisissä rakenteissa.
Toisaalta metallisissa superoksideissa, kuten kalium -superoksidissa (KO2), happi on kuin ioni tai2-. Metalliperoksidien ollessa bariumperoksidi (Bao2), happi esitetään ionina tai22- (BA2+JOMPIKUMPI22--A.
Isotoopit
Hapella on kolme stabiilia isotooppia: 16Tai 99,76%: n runsaudella; hän 17Tai, 0,04%; ja 18Tai 0,20%. Huomaa, että hän 16Tai se on ylivoimaisesti vakain ja runsas isotooppi.
Elektroninen rakenne ja kokoonpano
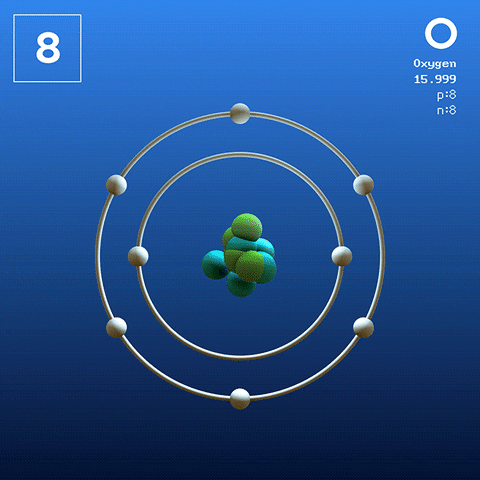
Happimolekyyli ja vuorovaikutukset
 Happimolekyyli. Lähde: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
Happimolekyyli. Lähde: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Happi perustilassaan on atomi, jonka elektroninen kokoonpano on:
[He] 2s2 2 p4
Valencia Link -teorian (TEV) mukaan kaksi happiatomia on kytketty kovalenttisesti siten, että molemmat erikseen täydentävät Valencian oktettinsa; Sen lisäksi, että pystyt pariutumaan heidän kaksi Orbitaals 2p: n yksinäistä elektronia.
Tällä tavoin happea diatominen molekyyli ilmestyy tai2 (Korkeampi kuva), jolla on kaksoissidos (O = O). Sen energian stabiilisuus on sellainen, että happea ei koskaan löydy yksittäisinä atomeina kaasumaisessa vaiheessa, vaan molekyyleinä.
Koska O2 Hän on homonukleaarinen, lineaarinen ja symmetrinen, puuttuu pysyvä dipolimomentti; Siksi sen molekyylien väliset vuorovaikutukset riippuvat sen molekyylimassasta ja Lontoon dispersiovoimista. Nämä voimat ovat suhteellisen heikko happea, mikä selittää miksi se on kaasu maanpäällisissä olosuhteissa.
Kuitenkin, kun lämpötila laskee tai lisää painetta, molekyylejä tai2 Ne pakotetaan yhtenäiseksi; siihen pisteeseen, että niiden vuorovaikutukset muuttuvat ja sallivat nesteen tai kiinteän hapen muodostumisen. Yrittää ymmärtää niitä molekyylisesti, on välttämätöntä, ettei O -2 rakenneyksikkönä.
Otsoni
Happi voi ottaa käyttöön muita huomattavasti stabiileja molekyylirakenteita; Eli sitä löytyy luonnosta (tai laboratoriosta) erilaisissa allotrooppisissa muodoissa. Otsoni (alempi kuva) tai3, Esimerkiksi se on tunnetuimman hapen toinen alotrooppi.
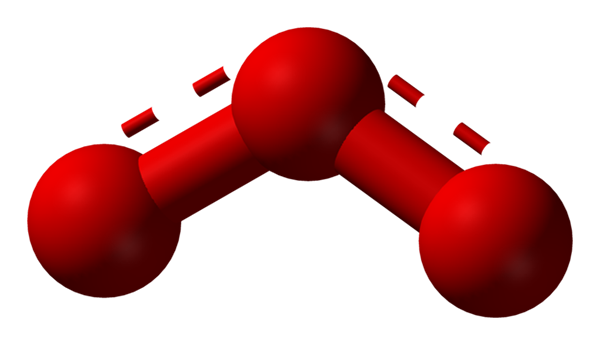 Resonanssihybridi rakenne, jota edustaa otsonimolekyylin pallo- ja tankojen malli. Lähde: Ben Mills Wikipedian kautta.
Resonanssihybridi rakenne, jota edustaa otsonimolekyylin pallo- ja tankojen malli. Lähde: Ben Mills Wikipedian kautta. Jälleen TEV pitää, selittää ja osoittaa sen tai3 On oltava resonanssirakenteita, jotka stabiloivat keskikeskuksen positiivisen muodollisen kuorman (punaisella pisteviivat); Vaikka happi bumerangin lopusta lähtien, negatiivinen kuorma jakautuu, aiheuttaen otsonin kokonaiskuorman.
Voi palvella sinua: Liukoisuussäännöt: Yleiset näkökohdat ja säännötTällä tavoin linkit eivät ole yksinkertaisia, mutta eivät kaksinkertaisia. Esimerkkejä resonanssihybrideistä ovat hyvin yleisiä niin monissa molekyyleissä tai epäorgaanisissa ioneissa.
O2 Minä3, Seurauksena on, että niiden molekyylirakenteet ovat erilaisia, sama koskee niiden fysikaalisia ja kemiallisia ominaisuuksia, neste- tai kidefaaseja (vaikka molemmat kuluttaisivat happiatomeja). He teorioivat tämän synteesin suurilla syklisen otsonin asteikolla, jonka rakenne muistuttaa punertavan ja hapetetun kolmion rakennetta.
Toistaiseksi hapen "normaalit alotropit" saapuvat. Kuitenkin on kaksi muuta harkita: o4 Minä8, löydetty tai ehdotettu vastaavasti nestemäisessä ja kiinteässä hapessa.
Nestemäinen happi
Kaasumainen happi on väritöntä, mutta kun lämpötila laskeutuu -183 ºC: e. Vuorovaikutukset molekyylien tai2 Nyt jopa heidän elektronit voivat absorboida fotoneja näkyvän spektrin punaisella alueella heijastamaan sen ominaisia sinistä väriä.
On kuitenkin teorioinut, että tässä nesteessä on enemmän kuin yksinkertaisia molekyylejä tai2, mutta myös molekyyli tai4 (Alempi kuva). Vaikuttaa siltä, että otsoni olisi "jumissa" toisen happiatomin, joka jotenkin välittää äskettäin kuvattu muodollinen muodollinen kuorma.
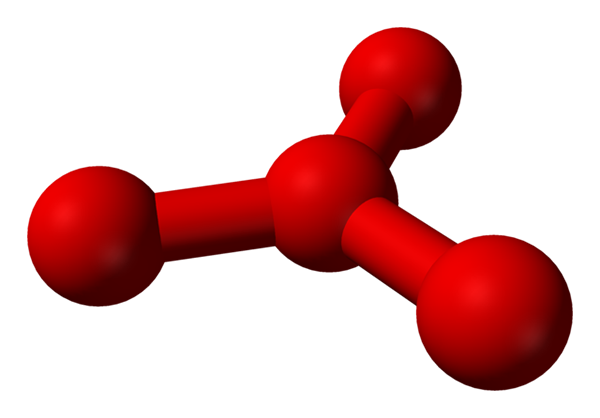 Malli ehdotettu rakenne, jossa on palloja ja tankoja tetraoksigeenimolekyylille. Lähde: Benjah-BMM27 [julkinen alue]
Malli ehdotettu rakenne, jossa on palloja ja tankoja tetraoksigeenimolekyylille. Lähde: Benjah-BMM27 [julkinen alue] Ongelmana on, että tietokone- ja molekyylisimulaatioiden mukaan O: n rakenne sanoi4 Se ei ole tarkalleen vakaa; He kuitenkin ennustavat, että ne ovat olemassa yksiköinä (tai2-A2, eli kaksi o -molekyyliä2 He lähestyvät niin paljon, että ne muodostavat eräänlaisen epäsäännöllisen kehyksen (atomit tai eivät ole linjassa keskenään).
Kiinteä happi
Kun lämpötila laskee -218,79 ºC, happi kiteytyy yksinkertaisessa kuutiorakenteessa (γ -faasi). Kun lämpötila laskee vielä enemmän, kuutiolasi kärsii siirtymistä β -vaiheisiin (rhomboédica ja -229,35 ºC) ja α (monokliininen ja -249,35 ºC).
Kaikki nämä kiinteän hapen kiteiset faasit tapahtuvat ympäristön paineessa (1 atm). Kun paine nousee arvoon 9 GPA (~ 9000 atm), Δ -faasi ilmestyy, jonka kiteet ovat oransseja. Jos paine kasvaa edelleen 10 GPA: ksi, punainen kiinteä happi ilmestyy tai vaihe ε (jälleen monokliininen).
Vaihe ε on erityinen, koska paine on niin valtava, että molekyylit tai2 Ne eivät ole vain yksiköinä tai4, mutta myös tai8-
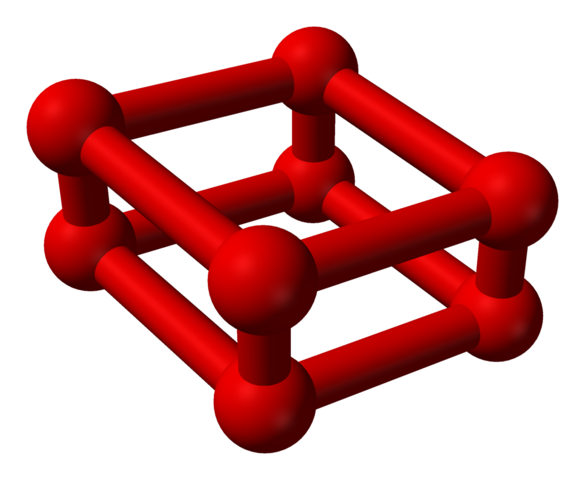 Mallirakenne, jossa on palloja ja palkkeja oktaoksigeenimolekyylille. Lähde: Benjah-BMM27 [julkinen alue]
Mallirakenne, jossa on palloja ja palkkeja oktaoksigeenimolekyylille. Lähde: Benjah-BMM27 [julkinen alue] Huomaa, että tämä tai8 Se koostuu kahdesta yksiköstä tai4 missä epäsäännöllinen kehys on jo selitetty. On myös pätevää pitää sitä neljänä tai2 tiiviisti linjassa ja pystysuorissa asennoissa. Sen vakaus on kuitenkin tämän paineen alla tai4 Minä8 Ne ovat kaksi ylimääräistä happea.
Ja lopuksi meillä on vaihe ζ, metalli (yli 96 GPA: n paineisiin), joissa paine saa elektronit dispergoitumaan lasiin; Kuten metallit.
Missä on ja tuotanto
Mineraalit
Happi on massassa maailmankaikkeuden kolmas elementti vedyn ja heliumin takana. Se muodostaa maankuoren runsas elementti, joka edustaa noin 50% sen massasta. Se yhdistetään pääasiassa piin kanssa piisoksidin muodossa (SiO2-A.
Happi on osa lukemattomia mineraaleja. Samoin se sijaitsee osana lukuisia yhdisteitä, kuten karbonaatteja, fosfaatteja, sulfaatteja, nitraatteja jne.
Ilma
Happi muodostaa 20,8% ilmakehän ilmaa tilavuudessa. Troposfäärissä se on pääasiassa kuin diatominen happimolekyyli. Stratosfäärissä ollessa kaasumainen kerros, joka on 15-50 km maan pintaa, on kuin otsoni.
Otsonia tuotetaan sähköisellä iskulla O: n molekyylissä2. Tämä hapen alotrooppi absorboi aurinkosäteilyn ultraviolettivaloa estäen sen haitallisen vaikutuksen ihmisille, mikä äärimmäisissä tapauksissa liittyy melanoomien ulkonäköön.
Tuore ja suolainen vesi
Happi on meriveden ja makean veden pääkomponentti järvistä, joista ja pohjavedestä. Happi on osa veden kemiallista kaavaa, mikä massii 89% siitä.
Toisaalta, vaikka hapen liukoisuus veteen on suhteellisen alhainen, tähän liuenneen hapen määrä on välttämätöntä vesielämälle, joka sisältää lukuisia eläinlajeja ja levää.
Elävät olennot
Ihminen muodostuu, noin 60% vedestä ja samalla happea runsaasti. Mutta lisäksi happi on osa lukuisia yhdisteitä, kuten fosfaatteja, karbonaatteja, karboksyylihappoja, ketoneja jne., jotka ovat välttämättömiä elämälle.
Happea esiintyy myös polysakkarideissa, lipideissä, proteiineissa ja nukleiinihapoissa; eli niin kutsuttuja biologisia makromolekyylejä.
Se on myös osa ihmisen aktiivisuuden haitallista tuhlausta, esimerkiksi hiilidioksidia ja dioksidia sekä rikkidioksidia.
Biologinen tuotanto
 Kasvit ovat vastuussa happiilman rikastumisesta vastineeksi hiilidioksidista, jota hengitämme. Lähde: Pexels.
Kasvit ovat vastuussa happiilman rikastumisesta vastineeksi hiilidioksidista, jota hengitämme. Lähde: Pexels. Happea esiintyy fotosynteesin aikana, prosessi, jolla meri kasviplanktoni ja maanpäälliset kasvit käyttävät kevyttä energiaa hiilidioksidin reagoimiseen veden kanssa, aiheuttaen glukoosia ja vapauttavan happea.
On arvioitu, että yli 55% fotosynteesin tuottamasta hapesta johtuu meren kasviplanktonin vaikutuksesta. Siksi se muodostaa maan päällä olevan hapentuotannon tärkeimmät lähteet ja on vastuussa elämän ylläpidosta.
Teollisuustuotanto
Ilman nesteyttäminen
Tärkein teollisen hapentuotantomenetelmä on luotu vuonna 1895, Karl Paul Gottfried von Linde ja William Hamson itsenäisesti. Tämä menetelmä käyttää tällä hetkellä joitain muutoksia.
Voi palvella sinua: butanone: rakenne, ominaisuudet ja käytötProsessi alkaa ilman puristuksella vesihöyryn tiivistämiseen ja siten sen poistaminen. Sitten ilma seulotaan, kun se suoritetaan zeoliitti- ja piidioksin seoksella hiilidioksidin, raskaiden hiilivetyjen ja muun veden eliminoimiseksi.
Myöhemmin nestemäisen ilman komponentit erotetaan murto -tislauksen avulla, saavuttaen sen eri kiehumispisteissä olevien kaasujen erotuksen. Tällä menetelmällä happi saadaan 99%: n puhtaudella.
Vesielektrolyysi
Happea tuotetaan erittäin puhdistetulla vesielektrolyysillä ja sähkönjohtavuudella, joka ei ylitä 1 µs/cm. Vesi erotetaan elektrolyysillä sen komponenteissa. Vety kationina siirtyy katodiin (-); Vaikka happi liikkuu kohti anodia (+).
Elektrodeilla on erityinen rakenne kaasujen keräämiseksi ja sen jälkeen nesteyttämisen tuottamiseksi.
Lämpöhajoamisen
Yhdisteiden, kuten elohopeaoksidin ja isäntä (kaliumnitraatti), lämpöhajoaminen vapauttaa happea, joka voidaan kerätä käytettäväksi. Peroksideja käytetään myös tähän tarkoitukseen.
Biologinen paperi
Happea tuottavat kasviplanktonit ja maasidit fotosynteesin kautta. Se ylittää keuhkojen seinämän ja veressä sen vangitsee hemoglobiini, joka kuljettaa sen eri elimiin ja sitten käytetään solujen aineenvaihduntaan.
Tässä prosessissa happea käytetään hiilihydraattien, rasvahappojen ja aminohappojen metabolian aikana lopulta hiilidioksidin ja energian tuottamiseksi.
Hengitys voi kaataa seuraavasti:
C6H12JOMPIKUMPI6 + JOMPIKUMPI2 => Co2 + H2Tai +energia
Glukoosi metaboloituu peräkkäisten kemiallisten prosessien sarjassa, joka sisältää glykolyysin, Krebs -syklin, elektronisen kuljetusketjun ja oksidatiivisen fosforylaation. Tämä tapahtumasarja tuottaa energiaa, joka kertyy ATP: ksi (Adenosín triposfaatti).
ATP: tä käytetään solujen erilaisissa prosesseissa, jotka sisältävät ionien ja muiden aineiden kuljetuksen plasmamembraanin läpi; aineiden suoliston imeytyminen; eri lihasolujen supistuminen; Eri molekyylien metabolia jne.
Polymorfonukleaariset ja makrofagien leukosyytit ovat fagosyyttisiä soluja, jotka kykenevät käyttämään happea superoksidi -ionin, vetyperoksidin ja yhden hapen tuottamiseen, joita käytetään mikro -organismien tuhoamiseen.
Riskejä
Hapen hengittäminen korkeisiin paineisiin voi aiheuttaa pahoinvointia, huimausta, lihaskouristuksia, näkökyvyn menetystä, kouristuksia ja tietoisuuden menetystä. Lisäksi puhtaan hapen hengitys pitkän ajan aiheuttaa keuhkojen ärsytystä, joka ilmenee yskällä ja hengityksen lyhentäminen.
Se voi myös olla syynä keuhkojen turvotuksen muodostumiseen: erittäin vakava tila, joka rajoittaa hengitystoimintaa.
Ilmapiiri, jolla on korkea happipitoisuus, voi olla vaarallinen, koska se helpottaa tulipalojen ja räjähdysten kehitystä.
Sovellukset
Lääkärit
Happea annetaan potilaille, joilla on hengitysvaje; Näin on potilaat, joihin keuhkokuume, keuhkoödeema tai emfyseema kärsivät. He eivät voineet hengittää ympäristöhappea, koska niihin vaikuttaisi vakavasti.
Potilaat, joilla on sydämen vajaatoiminta, nestemäisessä kertymisessä alveoleissa tarvitsevat myös happea; Kuten potilaat, jotka ovat kärsineet vakavasta verisuonitapauksesta (aivohalvaus).
Ammatillinen tarve
Palomiehet, jotka taistelevat tulipaloa ympäristössä, jolla on sopimaton tuuletus, vaativat naamioiden ja happipullon käyttöä, jotka antavat heille mahdollisuuden suorittaa tehtävänsä, asettamatta elämäänsä suurempiin riskeihin.
Sukellusveneet on varustettu hapentuotantolaitteilla, joiden avulla merimiehet voivat pysyä suljetussa ympäristössä ilman ilmakehän ilmanhoitoa.
Sukeltajat tekevät työnsä upotettuna veteen ja siksi eristettynä ilmakehän ilmasta. Ne hengittävät happea, joka pumpataan skannaukseen kytkettyihin putkiin tai sukellusveneen runkoon kiinnitettyjen pommitusten käyttö.
Astronautit suorittavat aktiviteettinsa happigeneraattoreilla varustetuissa ympäristöissä, jotka sallivat selviytymisen avaruusmatkojen aikana ja avaruusasemalla.
Teollisuus-
Yli 50% teollisesti tuotetusta hapesta kulutetaan raudan muuttuessa teräkseksi. Valuraudassa injektoidaan happisuihku rikin ja hiilen poistamiseksi; reagoi tuottamaan niin kaasuja2 ja yhteistyökumppani2, vastaavasti.
Asetyleeniä käytetään yhdessä hapen kanssa metallilevyjen leikkaamiseen ja myös sen hitsauksen tuottamiseen. Happea käytetään myös lasintuotannossa, lisäämällä sen leivontaansa palamista sen läpinäkyvyyden parantamiseksi.
Atomien absorptiospektrofotometria
Asetyleenin ja happea.
Menettelyn aikana liekki vaikuttaa lampun valopalkkiin, joka on erityinen elementille, jota halutaan kvantifioida. Liekki absorboi lampun valoa, mikä mahdollistaa elementin kvantifioinnin.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2019). Happi. Haettu: vuonna.Wikipedia.org
- Richard Van Noordden. (13. syyskuuta 2006). Vain kaunis vaihe? Kiinteä punainen happi: hyödytön, mutta ihana. Toipunut: luonto.com
- Azonano. (4. joulukuuta 2006). Kiinteä happi-e-faasikidistrupituuri määritetty happea O8-klusterin havaintoja pitkin. Toipunut: Azonano.com
- Kansallinen bioteknologiatietojen keskus. (2019). Happimolekyyli. Pubchem -tietokanta. CID = 977. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- DR. Doug Stewart. (2019). Happielementti tosiasiat. Kemikooli. Toipunut: Chemicool.com
- Robert C. Räjähdysmäinen. (9. heinäkuuta 2019). Happi: kemiallinen elementti. Encyclopædia britannica. Toipunut: Britannica.com
- Wiki -lapset. (2019). Happiperhe: Via -elementtien ominaisuudet. Palautettu: yksinkertaisesti.Tiede
- Advameg, Inc. (2019). Happi. Toipunut: Madhow.com
- Lentech b.V. (2019). Aikataulukko: happi. Toipunut: lentech.com
- New Jerseyn terveys- ja vanhempien palvelujen laitos. (2007). Happi: vaarallinen ainetietolomake. [PDF]. Palautettu: NJ.Hallitus
- Yamel Mattarollo. (26. elokuuta 2015). Teollisuushappi teollisuussovellukset. Toipunut: altecders.com
- « Neonhistoria, ominaisuudet, rakenne, riskit, käyttötarkoitukset
- Histidiiniominaisuudet, rakenne, toiminnot, ruoka »

