Holmio

- 3241
- 70
- Dr. Travis Reichert
 Metallinen Holmin ultrapiikkien näyte. Lähde: Hi-Res-kuvat kemiallisista elementeistä [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)]
Metallinen Holmin ultrapiikkien näyte. Lähde: Hi-Res-kuvat kemiallisista elementeistä [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)] Mikä on holmio?
Hän Holmio Se on metallielementti, joka kuuluu lohkoon F jaksollisesta taulukosta, erityisesti Lantanides -ajanjaksolle. Siksi se on harvinaisten maametallien jäsen, Erbion, Itrio, Disposio ja Iterbion vieressä. Kaikki nämä muodostavat sarjan mineraaleja (Xenotima tai Gadolinita), joita on vaikea erottaa tavanomaisilla kemiallisilla menetelmillä.
Sen kemiallinen symboli on HO, jonka atomismäärä on 67, ja se on vähemmän runsas kuin naapureidensa disposio (66Dy) ja Erbio (68Er). Sitten sanotaan, että Oddo-harkins-sääntö tottelee. Holmius on yksi niistä harvinaisista metalleista, joita melkein kukaan ei tiedä tai epäilee sen olemassaoloa; Jopa kemikaalien keskuudessa sitä ei yleensä mainita kovin usein.
Lääketieteen aloilla Holmio tunnetaan laserin käytöstä leikkauksissa eturauhasen patologioiden torjumiseksi. Se edustaa myös lupaavaa materiaalia sähkömagneettien ja kvanttitietokoneiden valmistukseen epätavallisten magneettisten ominaisuuksiensa vuoksi.
Holmiumyhdisteet, kolmiulotteinen, Ho3+, Ne esittävät ominaispiirteet, jotka osoittavat väriä, joka riippuu valosta, jolla he ovat säteily. Jos tämä on fluoresoivaa, näiden yhdisteiden väri muuttuu keltaisesta vaaleanpunaiseksi. Samoin se tapahtuu ratkaisuillaan.
Historia
Holmion löytäminen johtuu kahdesta sveitsiläisestä kemikaalista, Marc Defontaine ja Jacques-Louis Soret, jotka havaittiin vuonna 1878 spektroskooppisesti analysoidessaan harvinaisten maametallien Geneven mineraaleissa. He kutsuivat häntä elementtiin x.
Vain vuotta myöhemmin, vuonna 1879, ruotsalainen kemisti Teodor Cleveä kohti hallitsi2JOMPIKUMPI3-A. Tämä muiden epäpuhtauksien saastunut oksidi osoitti ruskeaa väriä, jonka hän nimitti 'Holmia', mikä tarkoittaa aivohalvausta latinaksi.
Voi palvella sinua: Exergoninen reaktio: Ominaisuudet ja esimerkitMyös Cleve sai toisen vihreän materiaalin: 'Thulia', josta tulee tuliooksidi. Tämän löytön ongelmana on, että yksikään kolmesta kemikaalista ei voinut saada riittävää näytettä puhtaana Holm -oksidista, koska se saastutti Docch -atomit, toinen lantanidimetalli.
Ranskalainen kemikaali, Boisbaudranin Paul LeCoq eristi Holm -oksidin fraktioneilla saostumilla ei ollut muuta kuin vuonna 1886. Myöhemmin tämä oksidi tehtiin kemialliset reaktiot holmio -suolojen tuottamiseksi, joita ruotsalainen kemisti Otto Holmberg vähensi vuonna 1911; Ja niin, ensimmäiset metalliset Holm -näytteet ilmestyivät.
Kuitenkin tällä hetkellä Holmion ionit, Hol3+, Ne uutetaan ioninvaihtokromatografialla sen sijaan, että turvautuisivat tavanomaisiin reaktioihin.
Holm -ominaisuudet
 Holmion sijainti jaksollisessa taulukossa. Lähde: Vektorisointi: Sushant Savla 05:51, 9. kesäkuuta 2019 (UTC), CC BY-SA 4.0, Wikimedia Commons
Holmion sijainti jaksollisessa taulukossa. Lähde: Vektorisointi: Sushant Savla 05:51, 9. kesäkuuta 2019 (UTC), CC BY-SA 4.0, Wikimedia Commons Fyysinen ulkonäkö
Hopea, pehmeä, muodollinen ja muokattava metalli.
Atominumero
67 (67Ho)
Moolimassa
164,93 g/mol
Sulamispiste
1461 ºC
Kiehumispiste
2600 ºC
Tiheys
Huoneenlämpötilassa: 8,79 g/cm3
Juuri kun sulaa tai sulaa: 8,34 g/cm3
Sulamislämpö
17 kJ/mol
Höyrystyslämpö
251 kJ/mol
Molaarinen lämpökapasiteetti
27,15 J/(mol · k)
Elektronegatiivisuus
1.23 Pauling -asteikolla
Ionisaatioenergiat
Ensimmäinen: 581,0 kJ/mol (Ho+ kaasumainen)
Toinen: 1140 kJ/mol (Ho2+ kaasumainen)
Kolmas: 2204 kJ/mol (Ho3+ kaasumainen)
Lämmönjohtokyky
16.2 w/(m · k)
Sähkövastus
814 nω · m
Hapetusluvut
Holm voidaan esitellä sen yhdisteissä seuraavilla numeroilla tai hapetustiloilla: 0, +1 (Ho+), +2 (Ho2+) ja +3 (Ho3+-A. Kaikista heistä +3 on ylivoimaisesti yleisin ja vakain. Siksi Holm on kolmiulotteinen metalli, joka muodostaa yhdisteitä (ionisia tai osittain ionisia), missä se osallistuu ho -ionina3+.
Voi palvella sinua: etyyliasetaattiEsimerkiksi seuraavissa yhdisteissä Holm löytyy +3 hapettumisnumerolla: Ho2JOMPIKUMPI3 (Ho23+JOMPIKUMPI32-), Ho (OH)3, Hoi3 (Ho3+Yllyttää3-) ja ho2(SW4-A3.
Ho3+ Ja sen elektroniset muutokset ovat vastuussa tämän metallin yhdisteistä. Kuitenkin, kun ne säteilevät fluoresoivalla valolla, ne muuttuvat vaaleanpunaiseksi. Sama koskee heidän ratkaisujaan.
Isotoopit
Holmio esitetään luonteeltaan yhtenä vakaan isotooppina: 165Ho (100% runsaus). On kuitenkin olemassa keinotekoisia radioisotooppeja, joilla on huomattavia puoli -elämää. Niiden välillä meillä on:
-163Ho (t1/2 = 4570 vuotta)
-164Ho (t1/2 = 29 minuuttia)
-166Ho (t1/2 = 26 763 tuntia)
-167Ho (t1/2 = 3,1 tuntia)
Magneettinen järjestys ja hetki
Holm on paramagneettinen metalli, mutta siitä voi tulla ferromagneettinen 19 K: n lämpötilassa, ja siinä on erittäin vahvat magneettiset ominaisuudet. Sille on ominaista magneettinen hetki (10,6 μB -) suurempi kaikista kemiallisista elementeistä, samoin kuin epätavallinen magneettinen läpäisevyys.
Reaktiivisuus
Holm on metalli, joka normaaleissa olosuhteissa ei oksaa liian nopeasti, joten sen kirkkauden menettäminen vie niin. Kuitenkin, kun häntä lämmitetään kevyemmällä, siitä tulee kellertävä, oksidikerroksen muodostumisen tuote:
4 ho + 3 o2 → 2 Ho2JOMPIKUMPI3
Reagoi laimennettujen tai konsentroituneiden happojen kanssa aiheuttamaan niiden suoloja (nitraatit, sulfaatit jne.-A. Ja yllättäen, se ei reagoi fluoriahapon kanssa, koska Hof -kerros3 suojaa sitä sen huonontumiselta.
Holmio reagoi myös kaikkien halogeenien kanssa tuottamaan vastaavia halogeenuroja (Hof3, Hocl3, Hobr3 ja Hoi3-A.
Kemiallinen rakenne
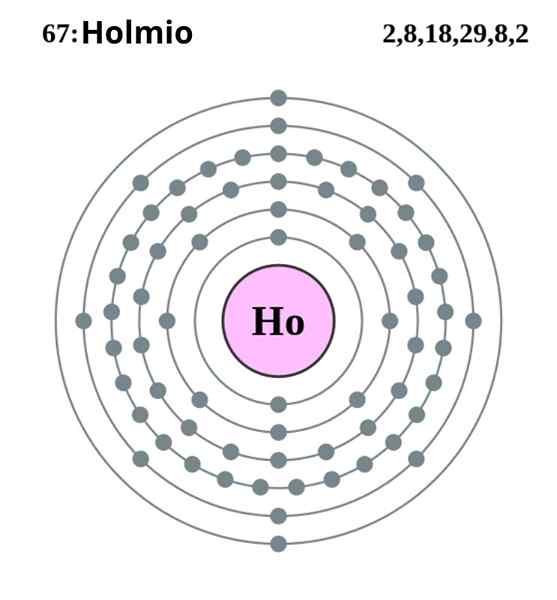 Holmio -elektroninen kokoonpano. Lähde: Pumba (Greg Robsonin alkuperäinen teos) Creative Commons -tukitusosuus samalla lisenssillä 2.0 Englanti ja Walesin maa
Holmio -elektroninen kokoonpano. Lähde: Pumba (Greg Robsonin alkuperäinen teos) Creative Commons -tukitusosuus samalla lisenssillä 2.0 Englanti ja Walesin maa Holmio kiteytyy pienikokoisessa kuusikulmaisessa rakenteessa, HCP (sen lyhenne englanniksi: läheinen pakattu kuusikulmainen). Teoriassa Ho -atomit pysyvät yhtenäisinä niiden 4f -kiertoradan elektronien muodostaman metallisidoksen ansiosta niiden elektronisen kokoonpanon mukaan:
Voi palvella sinua: laimennus: käsite, miten se tehdään, esimerkkejä, harjoituksia[Xe] 4fyksitoista 6s2
Tällaiset vuorovaikutukset ja sen elektronien energiajärjestelmä määrittelevät Holmion fysikaaliset ominaisuudet. Tätä metallia ei tunneta mitään muuta alotrooppia tai polymorfia, edes korkeissa paineissa.
Sovellukset
Ydinreaktiot
Holmio -atomi on hyvä neutronien absorboiva, joten se auttaa hallitsemaan ydinreaktioiden kehitystä.
Spektroskopia
Holmio -oksidiliuoksia käytetään kalibroimaan spektrofotometriä, koska niiden absorptiospektri on melkein aina jäljellä, riippumatta sen sisältämistä epäpuhtauksista. Se osoittaa myös erittäin tyypillisiä akuutteja nauhoja, jotka liittyvät Holmio -atomiin, ei sen yhdisteisiin.
Värjäys
Holmio -atomit kykenevät tarjoamaan punertavia väriä lasille ja keinotekoisille helmille kuutiometriä.
Magneetit
Äärimmäisen alhaisissa lämpötiloissa (30 K tai vähemmän) Holmiusilla on mielenkiintoisia magneettisia ominaisuuksia, joita käytetään tehokkaiden elektroomien valmistukseen, missä se auttaa keskittymään tuloksena olevaan magneettikenttään.
Tällaiset magneettiset materiaalit on tarkoitettu ydinmagneettiresonanssille; kiintolevyjen kehittämiseen muistojen kanssa, jotka värähtelevät petabyyttien tai teratavujen järjestyksessä; ja mahdollisesti kvanttitietokoneiden valmistamiseksi.
Holmio -laser
Itititrio-alumiinia granaattikide (YAG) voi seosta holmio-atomien kanssa säteilyn säteilyn säteilyn säteilyn säteilyn säteilemiseksi; Eli meillä on holm -laser. Hänen ansiosta kasvainkudos voidaan leikata tarkasti aiheuttamatta verenvuotoa, koska energia toimitti haavat välittömästi.
Tätä laseria on käytetty toistuvasti eturauhasen ja hammasleikkauksiin, samoin kuin syöpäsolujen ja munuaiskivien poistamiseen.

