Kemiallinen hitaus

- 4045
- 603
- Ronald Reilly
Mikä on kemiallinen hitaus?
Kemiallinen hitaus on ominaisuus, jolla on aine tai materiaali kestämään ulkoisten aineiden aiheuttamaa hajoamista. Tässä mielessä sen fysikaaliset ominaisuudet ja etenkin kemikaalit pysyvät ennallaan. Uusien linkkitaukoja tai muodostumista ei ole.
Nyt kemiallinen hitaus on suhteellinen. Jotkut aineet tai materiaalit ovat inerämpiä kuin toiset, mikä johtuu niiden vuorovaikutuksen luonteesta ja vahvuudesta. Kuten periaatteessa voisi periaatteessa kontrastin muutoksen ilmiöitä, välttämättömiä aineen kehittymiseksi erilaisissa tuotteissa.
 Kulta kurkisti. Kulta on korroosio enemmän kestävää metallia
Kulta kurkisti. Kulta on korroosio enemmän kestävää metallia Siksi kuitenkin inertti, että se on aine tai materiaali, on aina tila, jossa siitä tulee reaktiivinen. Esimerkiksi kulta on jalo metalleista, ja sitä pidetään inertinä. Sitä hyökkää ja liuottaa Royal Water, liuos, johon se on hyvin reaktiivinen.
Ehkä ja tähän mennessä ainoa kemiallinen elementti, joka on osoittanut absoluuttisen kemiallisen hitauden, on neon. Yhtään yhdistettä ei tunneta, edes ultraputkien olosuhteissa, kuten planeettojen tai kuunen ytimissä.
Kemiallisen hitauden ominaisuudet
Hapettumisen puute
Jotta materiaali tai aine on inertti, periaatteessa sen ei pitäisi reagoida ympäröivän ilman kanssa. Tämä tarkoittaa, että sillä ei ole taipumusta muodostaa yhteyksiä happea tai typpimolekyyleihin, jotka ympäröivät sen pintaa. Toisin sanoen: älä hapettele ilmavalotusta.
Ruoka ja kaikki kyseiset orgaaniset aineet yleensä hapettua. Siksi sanotaan, että he eivät ole inerttejä.
Kemiallisen hitauden hapettumisen puute tulisi ylläpitää yli 100 ºC: n lämpötiloissa. Mitä korkeampi lämpötila, aineet tai materiaalit alkavat hapettua nopeammin, reagoidessaan ilman happea tai typpeä muodostaen vastaavasti oksideja tai nituroja.
Happoresistenssi tai alkalis
Toinen kemiallisessa hitausominaisuus on resistenssi hapoille tai emäksille. Tämä tarkoittaa, että inertin aineen tai materiaalin tulisi vastustaa happojen hyökkäystä ilman taipumusta hajottaa H -ionien hyväksymällä+ tai erittäin vahvat elektrofiilit; tai tukikohtien hyökkäys, halventamatta OH -ionien takia-.
Se voi palvella sinua: perbromiinihappo (HBRO4): Ominaisuudet, riskit ja käytötTämä on jälleen suhteellista, koska happoja ja emäksiä on erityyppisiä. Jotkut inertit aineet voivat olla erittäin resistenttejä esimerkiksi rikkihapolle, mutta ne hajoavat fluorhoridihapon alemman pisaran sijasta. Näin on lasipullot, kun ne reagoivat HF: n kanssa.
Elektroninen vakaus
Yllä olevat ominaisuudet liittyvät termodynaamiseen stabiilisuuteen, joka on johdettu molekyylien välisten vuorovaikutusten luonteesta muiden tekijöiden lisäksi. Toisaalta kemiallinen hitaus on myös vilkaistu samojen atomien elektronisissa ominaisuuksissa.
Mitä vakaampi atomin elektroninen kokoonpano, sitä pienempi sen taipumus voittaa tai menettää elektroneja. Siksi sillä on suurempi kemiallinen hitaus. Näin on jalokaasut, jotka nähdään seuraavassa osassa.
Bioinaktiivisuus
Lääketieteessä aine tai materiaali on inertti, jos siitä puuttuu bioaktiivisuus. Toisin sanoen se voidaan sijaita organismin sisällä ilman, että sitä rinnastetaan sen aineenvaihdunnan aikana. Tämä ominaisuus on erittäin toivottava luuproteesissa tai kudoksen jälleenrakennuksessa.
Säteilykestävyys
Lopuksi, inerttien aineiden tai materiaalien tulisi myös olla säteilyn kestäviä, olla ultravioletti tai ydin.
Esimerkkejä kemiallisesta hitaudesta
Lasi
 Lasi on suhteellisen inertti materiaali
Lasi on suhteellisen inertti materiaali Esimerkkejä materiaaleista, joilla on kemiallinen hitaus, meillä on lasi. Jos ne eivät olisi inerttejä, he eivät palvelisi astioiden tai astioiden kehittämistä, koska he reagoivat heidän sisällönsä kanssa. Koostumuksestaan, kuten borosilikaatteihin, riippuen niistä voi tulla erittäin resistenttejä korroosiolle ja lämpötilaan.
Kuten alussa mainittiin, lasi ei kuitenkaan ole immuuni kaikille aineille: se reagoi HF: n kanssa, jopa laimennettu, kuuma emäksinen, kuten NaOH ja H3Poikki4 Erittäin keskittynyt ja kuuma.
Voi palvella sinua: pyrolyysiMuovit
 Jos Teflonin pannu ei olisi inertti, se pilaa kaikki ruoat. Lähde: Mdevicente, CC0, Wikimedia Commons
Jos Teflonin pannu ei olisi inertti, se pilaa kaikki ruoat. Lähde: Mdevicente, CC0, Wikimedia Commons Muovit täyttävät myös lasin kaltaiset toiminnot, mutta on paljon enemmän monipuolisempaa (ne eivät rikkoo niin helposti). Jotkut muovit, kuten teflon (polytetrafluorietyleeni), kynar (polyvinylideenifluoridi) ja teleeni (polydikosyklopentadienia), ovat erittäin kestäviä happojen ja korroosion hyökkäyksille.
Keramiikka
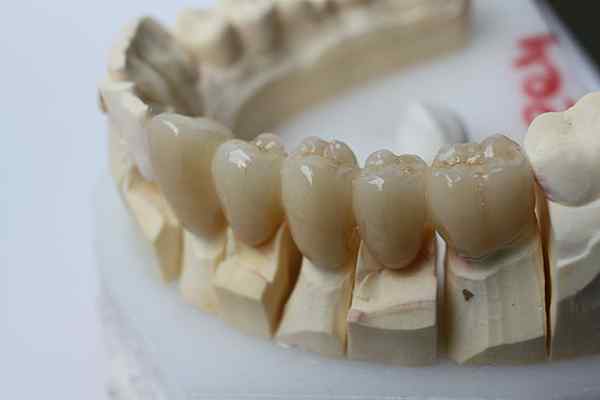 Zirkoniumoksian kemiallinen hitaus mahdollistaa sen käytön hammasproteesissa. Lähde: Bin IM Garten Wikipedian kautta.
Zirkoniumoksian kemiallinen hitaus mahdollistaa sen käytön hammasproteesissa. Lähde: Bin IM Garten Wikipedian kautta. Inertti keramiikka menee askeleen pidemmälle kuin muovit. Ne on tarkoitettu sovelluksiin, joissa korkeat lämpötilat ovat vallitsevia, melko tavallisia auto- ja ilmailualan teollisuudessa; tai biokemiallisissa järjestelmissä, kuten lääketeollisuudessa ja luuproteesien toteuttamisessa.
Joidenkin näiden keramiikoista, joilla on suuri kemiallinen hitaus, meillä on: alumiinioksidi (2JOMPIKUMPI3, Läsnä Corindonissa ja safiirissa), silikaatteja (erikoistunutta lasi), piikarbidia (sic, kovaa ja sitkeää) ja zirkoniumoksidia (zio2-A.
Hitauskaasut
Jättäen inertit materiaalit syrjään, meillä on nyt inerttejä aineita. Inertit kaasut eivät ole kovin reaktiivisia, joten niiden läsnäolo ilmassa ei tarkoita mitään reaktioriskiä normaaleissa olosuhteissa.
Näistä kaasuista meillä on CO2, Co ja n2. Typpi on kaikkien näiden kaasujen inertti; Ja silti hän pystyy reagoimaan kuumana joidenkin metallien kanssa muodostaakseen Nitturos, M3Nn, olemus n Valencia tai metallin hapettumistila.
Yhteistyökumppani2 Se on suhteellisen inertti; Lukuun ottamatta silloin, kun se kohtaa alkaliset liuokset, missä se muuttuu karbonaateiksi tai hiilihydraisten entsyymien läsnä ollessa.
CO on puolestaan inertti huoneenlämpötilassa; Mutta korkeissa lämpötiloissa se reagoi hiilen, vesihöyryn, metallioksidien, olefiinien kanssa muun muassa yhdisteiden joukossa.
Voi palvella sinua: Kemiallinen tasapaino: Selitys, tekijät, tyypit, esimerkitTällaiset reaktiot voivat edetä metallikatalyyttien läsnä ollessa. Samoin CO, jopa rikkomatta sen kovalenttisia sidoksia, kykenee koordinoimaan neutraaleja metalliatomeja.
Jalometallit
Noble -metallit ovat eniten resistenttejä happojen korroosiolle ja hyökkäykselle ja alkalista. Jokainen korkeissa lämpötiloissa tai pölymuodossa reagoi hapen tai fluoridin kanssa. Siksi näiden elementtien kemiallinen hitaus on melko suhteellinen.
Meillä on jalometalleja: kulta (Au), Ruthenio (Ru), Platinum (PT), Paladio (PD), Osmio (OS) ja Iridido (IR). Kaikista heistä kulta on jaloin, koska se on jopa metallisessa tilassa maankuoressa.
jalokaasut
Ja lopuksi, kemiallisen hitauden korkeimmassa paikassa meillä on jaloja kaasuja: helium (He), neon (NE), Argon (AR), Crypton (KR), Xenon (XE) ja Radon (RN). Ne kaikki ovat erittäin inerttejä. Ksenonin yhdisteitä on kuitenkin syntetisoitu, mukaan lukien Perxenatos -nimiset suolat, XEO -anionin kanssa64-.
 Neonvalot vastaavat luonnon inerttejä kemiallisia elementtejä
Neonvalot vastaavat luonnon inerttejä kemiallisia elementtejä Sen kemiallinen hitaus johtuu siitä, että niiden atomit sisältävät energia- ja kiertoradan kerroksensa täysin täynnä elektroneja. Argonista on mahdollista, että ultrapressioissa he pääsevät elektroneihin käyttämällä tyhjiä kiertoratoja tai enemmän energiakerroksia (esimerkiksi 3D ja 4S); asia, joka on mahdotonta heliumille tai neonille.
Jalokaasuista tarkalleen helium ja neon ovat eniten inerttejä. Helium kykenee muodostamaan yhdisteitä, joissa on natriumin erittäin suuriin paineisiin (Hena).
Samaan aikaan mitään yhdistettä ei tiedetä ollenkaan, koska se on vielä enemmän inertissä kuin Helium itse hänen tehokkaamman ydinkuormansa vuoksi, joka hylkää voimakkaasti kaikki atomit, jotka yrittävät lähestyä neoniatomeja.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Shiver & Atkins. (2008). Inorgán -kemiaICA. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2020). Kemiallisesti inertti. Haettu: vuonna.Wikipedia.org
- DR. Doug Stewart. (2020). Määritelmä inertti. Toipunut: Chemicool.com
- Elsevier B.V. (2020). Kemiallinen inertti. Tiede. Haettu: ScienEdirect.com
- Clara Moskowitz. (20. maaliskuuta 2018). Noble -kaasun yllätys: Helium voi muodostaa outoja yhdisteitä. Toipunut: Tieteellinen amerikkalainen.com
- Koorstek. (2020). Teknisen keramiikan kemialliset ominaisuudet. Toipunut: Coorstek.com
- Osborne -teollisuus. (2020). 3 hapankestävää muovia. Toipunut.com

