Hydronio -ioni
- 1329
- 157
- Louis Moen
Mikä on hydronium -ioni?
Hän Hydronio -ioni Se on eräänlainen positiivinen kuorma, joka johtuu vesimolekyylin protoneista ja jonka kemiallinen kaava on H3JOMPIKUMPI+. Se koostuu yksinkertaisimmista oksonialaisista: ionit, joissa happea on positiivinen muodollinen kuorma ja siinä on kolme kovalenttista sidosta.
H3JOMPIKUMPI+ Se on yksi yksinkertaisimmista, mutta uteliaista kationeista. Vedessä normaaleissa olosuhteissa sen pitoisuus on 1,10-7 M, itsehallintatasapainon tuote. Sen pitoisuus kuitenkin kasvaa eksponentiaalisesti, kun vahva3JOMPIKUMPI+ Ne liukenevat veteen, happamassa sitä.
 Hydronium -ionimolekyyli
Hydronium -ionimolekyyli H: n pitoisuus tai aktiivisuus3JOMPIKUMPI+ Vedessä se aikoo mitata vesiliuosten happamuutta: pH. Mitä enemmän H -ioneja3JOMPIKUMPI+ Heinä, vähemmän positiivinen on pH, ja enemmän happoa on kyseinen ratkaisu. Tämä happamuus puolestaan on vety -ionissa, H+, joka on usein hämmentynyt ion H: n kanssa3JOMPIKUMPI+.
 Ionin tai hydroniokationin kaava
Ionin tai hydroniokationin kaava H+ ja sen hämmästyttävä kyky siirtyä vesimolekyylien vety sillojen välillä sallii H: n3JOMPIKUMPI+ assosioitu monimutkaisemmissa kationin muodostelmissa; kuten Eigenin kationi, H9JOMPIKUMPI4+, ja Zundelin kationi, H5JOMPIKUMPI2+, ja monet muut.
Hydronium -ionirakenne
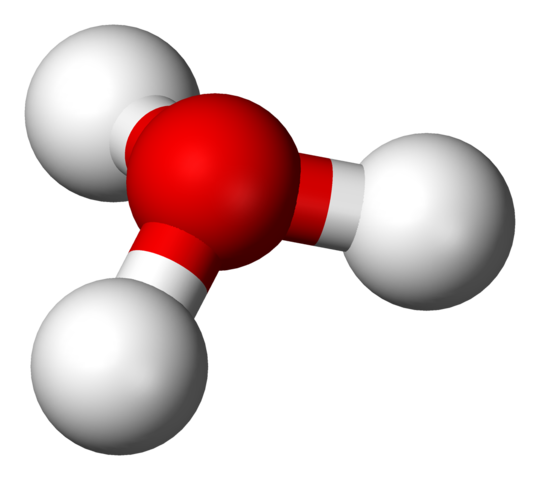 H3O+ rakenne palloilla ja baarimallilla
H3O+ rakenne palloilla ja baarimallilla Ensimmäisessä kuvassa voit nähdä Hydrium -ionin rakenteellisen kaavan. Nyt näemme sen esityksen palloilla ja baarimallilla. Molemmissa korostetaan trigonaalista pyramidigeometriaa, jonka linkkikulmat (O-H) on 113º; Hieman ohjattu 119º: sta tetraedrille.
Vaikka hapella on positiivinen osittainen kuorma, tämä ei tarkoita, että negatiivinen alue on vetyatomien ympärillä. Päinvastoin. Happi h3JOMPIKUMPI+ Se on vielä elektronegatiivisempi tuote sen elektronisesta puutteesta; Joten kaikki negatiiviset tiheydet visualisoivat sähköstaattisella potentiaalikartalla:
Voi palvella sinua: kaliumsulfaatti (K2SO4): rakenne, ominaisuudet, käytöt, synteesi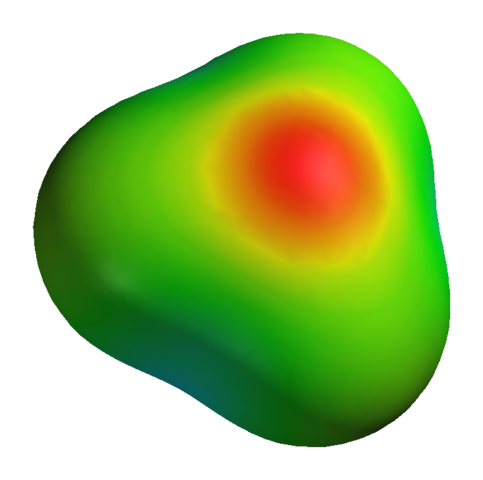 Sähköstaattinen potentiaalikartta H3O: lle+
Sähköstaattinen potentiaalikartta H3O: lle+ Puhumattakaan siitä, että happea on pari vapaata elektronia, mikä vahvistaa vielä enemmän negatiivista tiheyttä.
Kaikkien edellä mainittujen seurauksena on, että H -hydrogenssit3JOMPIKUMPI+ Ne menettävät elektronisen tiheyden, koska happi houkuttelee sitä itseään. Siksi h3JOMPIKUMPI+ Voit luoda erittäin vahvoja vetylähteitä viereisen vesimolekyylin kanssa: H2JOMPIKUMPI+-H-OH2.
Tämä vuorovaikutus on avain H: n hämmästyttävän ionisen liikkuvuuden takana+ ja miksi h3JOMPIKUMPI+ Se pystyy yhdistämään moniin vesimolekyyleihin samanaikaisesti.
Happamuus
Hydronio -ioni on erittäin vahva happo. Itse asiassa vesiliuoksessa voi olla vahvin happo. Koska? Koska mikä tahansa muu happo, joka on häntä vahvempi3JOMPIKUMPI+-
Ha + h2O → a- + H3JOMPIKUMPI+
H3JOMPIKUMPI+ Se pystyy pysymään vakaana aina, kun ympäristössä ei ole muita emäksiä, jotka ovat vahvempia kuin vesi. Mikä tahansa happo on noudattanut tätä luokitellaan vahvaksi hapoksi. Sillä välin, jos happo on heikompi kuin h3JOMPIKUMPI+, Silloin osaa HA: ta ei ole täysin dissosioitunut ja puhumme heikoista haposta:
Ha + h2Tai ⇌ a- + H3JOMPIKUMPI+
Siksi, koska h3JOMPIKUMPI+ Se on vedessä voimakkain happo, tämän happamuus riippuu H: n pitoisuudesta3JOMPIKUMPI+. Tämä on perusta määrittelemään yksinkertaisesti pH: ksi ilmaistun vesiliuoksen happamuus:
ph = -log [h3JOMPIKUMPI+-
H+ vs. H3JOMPIKUMPI+
Vety -ioni ja hydronium eivät ole samoja. H+ Se on paljon happamempi kuin h3JOMPIKUMPI+, No, se koostuu protonista, joka ei enää etsiä molekyyliä elektronien saamiseksi kaikin tavoin. Kun h+ Hanki vesimolekyyli H -muodossa H3JOMPIKUMPI+-
Se voi palvella sinua: kuplioksidi (CuO)H+ + H2O → h3JOMPIKUMPI+
Siksi h3JOMPIKUMPI+ voidaan edustaa h: nä+(Ac), mikä osoittaa, että se on H+ Vesipitoisessa väliaineessa.
Hapon voima mitataan sen kyvyssä lahjoittaa, Brönsted-matala, H-ionien määritelmän mukaan H-ionit+. Kuinka paljon vahvempaa se on, sitä enemmän se lahjoittaa+, Ei h3JOMPIKUMPI+. Vahvimmat hapot, jotka koskaan syntetisoidut (superhiidit) ovat ne, joissa H+ Hän on "alasti"; toisin sanoen ilman esteitä hypätä kohti molekyyliä, joka protonoi.
H: n edustaminen3JOMPIKUMPI+ h+(AC) On niin yleistä, että on monta kertaa puhumista molemmista kuin ne olisivat samat, ilman että negatiivisesti vaikuttavat ratkaisujen kemian tulkintaan.
Solvaatio
H3JOMPIKUMPI+ Se voi muodostaa erittäin voimakkaita vety silloja viereisen vesimolekyylin kanssa. Näin tekemällä meillä on Zundelin kationi, H5JOMPIKUMPI2+-
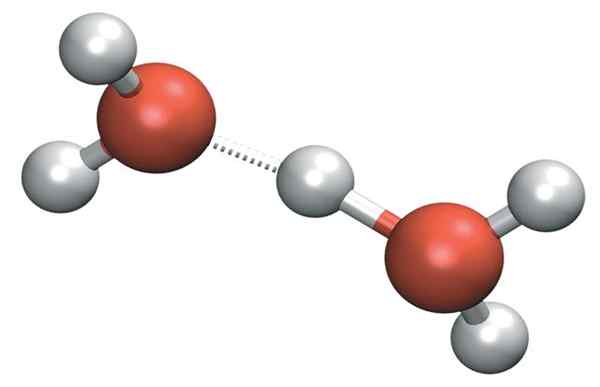 Zundelin kationi
Zundelin kationi Mutta positiivinen kuorma ei vain pysy yhdellä kationin yhdellä puolella: tämä voidaan siirtää toiseen vesimolekyyliin, kuten ioni H+-
H2Vai niin-+vai niin2 → H2JOMPIKUMPI+-H- oh2
Siksi positiivinen kuormitus jakautuu kahden happiatomien välillä kahdelle vesimolekyylille.
Ominaiskationin tapauksessa H9JOMPIKUMPI4+, h3JOMPIKUMPI+ Muodosta vety sillat kolmella vesimolekyylillä, jakaen niiden keskenään positiivisen kuorman "hypyn" ansiosta+. Nämä hyppyt ovat niin nopeita, että ne selittävät H: n suuren ionisen liikkuvuuden+ Vedessä, käyttämällä H3JOMPIKUMPI+ ajoneuvona ja vesimolekyyleinä kuin moottoritiellä.
H5JOMPIKUMPI2+ ja h9JOMPIKUMPI4+ Ne eivät ole ainoat kationiset yhdistykset, jotka h3JOMPIKUMPI+ voi olla peräisin vedestä. Jotkut molekyylidynamiikan laskelmat osoittavat H -klusterin olemassaolon3JOMPIKUMPI+(H2JOMPIKUMPI)kaksikymmentä: 20 h molekyylit2Tai vuorovaikutuksessa kationin kanssa3JOMPIKUMPI+ ja jakelu heidän keskenään positiivinen kuorma.
Voi palvella sinua: neodyymi: rakenne, ominaisuudet, käytötSiksi h3JOMPIKUMPI+ ja h+ Ne rakentavat utelias suhteen vesimolekyyleihin, happamuuden ulkopuolelle.
Menet ulos
Aivan kuten orgaaniset happihuoneet ovat olemassa, se ei ole poikkeus, jossa happi on johdettu veden protonaatiosta. Sen yleinen kaava on [h3JOMPIKUMPI+] [X-], Missä x- Se on mikä tahansa anioni, joka tulee erittäin vahvan hapon liukenemisesta.
Nämä suolat saavat joskus nimen 'monohydraattihapot', koska kaava [H3JOMPIKUMPI+] [X-tai h3JOMPIKUMPI+· X- Se voidaan kirjoittaa myös hx · h2JOMPIKUMPI. Siten voi olla dihydraattihapoja, HX · 2H2Tai, trihydraatit, hx · 3h2Tai, jne.
Esimerkiksi HCl voi kiteyttää hcl · h2VAI NIIN3JOMPIKUMPI+· Cl-. Meillä on myös muita hydroniumsuoloja, kuten h3JOMPIKUMPI+· Clo4- tai hclo4· H2Tai ja HBR · 4H2VAI NIIN3JOMPIKUMPI+· BR-· 3H2JOMPIKUMPI.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Shiver & Atkins. (2008). Inorgán -kemiaICA. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2020). Hydronium. Haettu: vuonna.Wikipedia.org
- Avneet Kahlon ja Stephen Lower. (15. elokuuta 2020). Hydronium -ioni. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Helmestine, Anne Marie, PH.D -d. (25. elokuuta 2020). Hydronium -ionin määritelmä. Toipunut: Admingco.com
- Enyclopaedia Britannica -toimittajat. (2020). Vety -ioni. Toipunut: Britannica.com

