Isóbaros
- 3155
- 426
- Gustavo Runte DVM
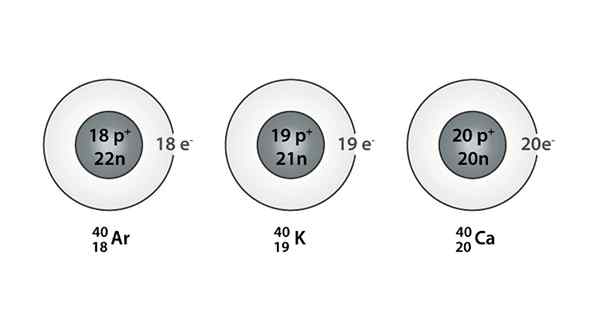
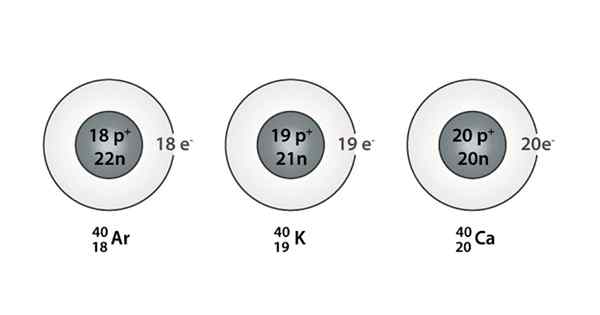 Esimerkki Isóbarosta; Argon, kalium ja kalsium, joilla on saman massan atomit (40)
Esimerkki Isóbarosta; Argon, kalium ja kalsium, joilla on saman massan atomit (40) Mitkä ovat isoparot?
Se Isóbaros Ne ovat niitä atomilajeja, joilla on sama massa, mutta jotka ovat peräisin eri kemiallisista elementeistä. Tämän seurauksena voidaan sanoa, että ne muodostuvat eri määrin protonien ja neutronien määrät.
Sekä protonit että neutronit ovat niiden atomien ytimessä, mutta kussakin ytimessä olevien neutronien ja protonien nettomäärä pysyy samana. Toisin sanoen Isóbara -laji on peräisin, kun parilla atomi -ytimiä on sama neutronien ja protonien nettomäärä jokaiselle lajille.
Kuitenkin neutronien ja protonien lukumäärä, jotka muodostavat kyseisen nettomäärän. Yksi tapa huomata se on tarkkailla massamäärää (joka on asetettu esitetty kemiallisen elementin symbolin vasemmalle puolelle), koska isopioissa tämä luku on sama on sama, sama on sama.
Isóbaro -termin etymologia tulee kreikkalaisista sanoista Isot (mikä tarkoittaa "samaa") ja Baros (mikä tarkoittaa "painoa"), joka viittaa kummankin ydinlajin välisten painojen tasa -arvoon.
Isoparosin ominaisuudet
- Isoparot säilyttävät tiettyjä yhtäläisyyksiä muiden lajien kanssa, joiden ytimissä on sattumia, kuten isotonoisia, joilla on sama määrä neutroneja, mutta joilla on erilaiset massa- ja atominumero, kuten ikätoverit 13C ja 14Ei 36S ja 37Cl.
- Termi "nukleidi" on nimellisarvo, joka on keksitty jokaiselle nukleajoukkoon (neutronien ja protonien muodostamat rakenteet), jotka voidaan muodostaa. Niin, että nukleidit voivat erottaa itsensä neutronien tai protonien lukumääränsä tai jopa energian määrän suhteen.
Voi palvella sinua: nesteyttäminen: konsepti, kaasut, maaperät ja seisminen, siemen- Samoin lasten ydin syntyy β: n jälkeen ja tämä prosessi puolestaan se on isän ytimen isopari, koska ytimessä olevien nukleonien lukumäärä pysyy muuttumattomana, toisin kuin hajoamisen α.
- On tärkeää muistaa, että erilaisilla Isóbaroilla on erilainen atomiluku, mikä vahvistaa, että ne ovat erilaisia kemiallisia elementtejä.
Esitys
Eri nukleidien merkitsemiseksi käytetään erityistä merkintää, jota voidaan edustaa kahdella tavalla: yksi koostuu kemiallisen elementin nimen asettamisesta, jota seuraa niiden massamäärä, joita yhdistää käsikirjoitus. Esimerkiksi: typpi-14, jonka ydin koostuu seitsemästä neutronista ja seitsemästä protonista.
Toinen tapa edustaa näitä lajeja on sijoittaa kemiallisen elementin symboli, jota edeltää numeerinen taikausaine, joka osoittaa kyseisen atomin hallussa olevan massamäärän, samoin kuin numeerisen alaindeksin, joka osoittaa sen atominumeron, seuraavalla tavalla -
Z -z-LlaX
Tässä ekspressiossa se edustaa kyseisen atomin kemiallista elementtiä, A on massamäärä (neutronien ja protonien määrän lisäyksen tulos) ja Z edustaa atomilukua (yhtä suuri kuin protonien määrä ytimessä atomi).
Kun nämä nukleidit on edustettuna, atomin (z) atomiluku on yleensä jätetty pois, koska se ei anna asiaankuuluvia lisätietoja, joten se on usein esitetty -LlaX.
Yksi tapa osoittaa tämä merkintä on ottaa edellinen esimerkki (typpi-14), joka on myös merkitty 14N. Tämä on isoboihin käytetty merkintä.
Voi palvella sinua: aineen laajat ominaisuudetEsimerkkejä Isóbarosista
ISóbarosin ekspression käyttöä lajeille, jotka tunnetaan nimellä nukleidit, joilla on sama määrä nukleoneja (yhtä suuri massamäärä), 1910 -luvun lopulla brittiläisen alkuperän Alfred Walter Stewartin kemistit Alfred Walter Stewart.
Tässä ideajärjestyksessä voidaan havaita esimerkki isoboista lajien tapauksessa 14C ja 14N: Massamäärä on yhtä suuri kuin 14, tämä tarkoittaa, että protonien ja neutronien lukumäärä molemmissa lajeissa on erilainen.
Tällä hiiliatomilla on todellakin 6. Sitten massamääräsi on 14 (6+8 = 14).
Typpiatomilla on puolestaan atomiluku, joka on yhtä suuri kuin 7, joten se koostuu 7 protoneista, mutta sen ytimessä on 7 neutronia. Massamääräsi on myös 14 (7+7 = 14).
Löydät myös sarjan, jossa kaikissa atomeissa on 40 -vuotiaiden massamäärä; Näin on Isóbaros: 40Ac, 40K -k -, 40AR, 40Cl, ja 40S.
Erot Isoton ja isotooppien välillä
Nukleidit kuvaavat olemassa olevia atomien ytimiä, jotka ovat olemassa.
Samoin tämäntyyppisten nukleidien välillä ovat isotropos ja isotoopit, jotka erotetaan alla.
ISóbarosin tapauksessa, kuten aiemmin mainittiin, niillä on sama määrä nukleoneja -se on sama massamäärä -missä protonien lukumäärä, jolla yksi laji on korkeampi kuin toinen, on samaa mieltä niiden neutronien lukumäärästä, jotka ovat alijäämä, joten kokonaismäärä on sama. Atomiluku on kuitenkin erilainen.
Se voi palvella sinua: kristalloidiliuokset: koostumus, tyypit ja esimerkitTässä mielessä isopiset lajit ovat peräisin eri kemiallisista elementeistä, joten ne sijaitsevat jaksollisen taulukon eri tiloissa ja niillä on erilaiset ominaisuudet ja erityiset ominaisuudet.
Toisaalta isotooppien tapauksessa päinvastoin tapahtuu, koska niillä on sama atomiluku, mutta erilainen massa; Eli heillä on sama määrä protoneja, mutta erilainen neutronien määrä atomiydinsä sisällä.
Lisäksi isotoopit ovat samoihin elementteihin kuuluvia atomislajeja, joten ne sijaitsevat samassa tilassa jaksollisessa taulukossa ja niillä on samanlaiset ominaisuudet ja ominaisuudet.

