Isoleusiinin ominaisuudet, toiminnot, biosynteesi, ruoka
- 4707
- 1386
- Gustavo Runte DVM
Se isoleusiini (Ile, i) on yksi 22 aminohapposta, jotka ovat luonteeltaan osana proteiineja. Kun otetaan huomioon, että ihmiskeho, kuten joidenkin muiden nisäkkäiden, ei voi syntetisoida sitä, isoleusiini on yhdeksän välttämätöntä aminohappoa, jotka on saatava ruokavaliolla.
Tämän aminohapon eristettiin ensimmäistä kertaa vuonna 1903 tiedemies F. Juurikka- tai juurikkaiden melassin typen ainesosat. Myöhemmin sama kirjailija erotti isoleusiinin fibriinin ja muiden proteiinien hajoamistuotteista.
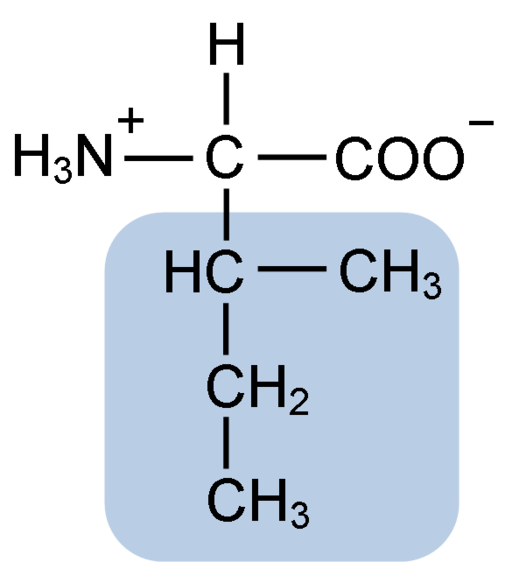
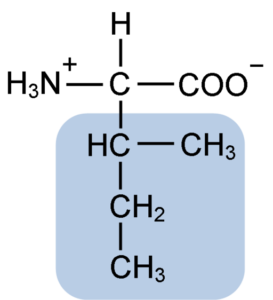 Isoleusiinin aminohapon kemiallinen rakenne (lähde: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta)
Isoleusiinin aminohapon kemiallinen rakenne (lähde: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta) Se on ei -polaarinen aminohappo, joka on läsnä suuressa osassa elävien organismien soluproteiineja. Lisäksi se on osa BCAA: n haarautuneita ketjun aminohappoja (englannista B -Karja- CHain -LlaEi -LlaCids), Yhdessä Leucinan ja Valinan kanssa.
Sillä on toiminnot monien proteiinien tertiäärisen rakenteen muodostumisessa ja osallistuu lisäksi solujenergian aineenvaihduntaan liittyvien erilaisten metabolisten esiasteiden muodostumiseen.
[TOC]
Ominaisuudet
Isoleusiini luokitellaan ei -polaariseen aminohapporyhmään, jossa on afaattisia ryhmiä tai ketjuja, ts. Hiilivetyhiilivetyketjujen kanssa.
Tämän ominaisuuden vuoksi tämän ryhmän aminohapot, kuten alaniini, Valina ja Leucina, pysyvät yleensä lähellä toisiaan, mikä edistää proteiinien stabilointia.
Tämä ei -polaarinen aminohappo painaa noin 131 g/mol ja sitä esiintyy proteiineissa lähellä 6%, "haudattu" niiden keskelle (hydrofobisten ominaisuuksien ansiosta).
Rakenne
Isoleusiini on α-aminohappo, jolla, kuten muilla aminohapolla, on keskeinen hiiliatomi, jota kutsutaan a: sta (joka on kiraalinen), johon on liitetty neljä eri ryhmää: vetyato, aminoryhmä (-NH2), A karboksyyliryhmä (-COH) ja sivuketju tai R Grupo.
Isoleusiiniryhmä R koostuu yksinkertaisesta haarautuneesta hiilivedystä, jossa on 4 hiiliatomia (-CH3-CH2-CH (CH3)), joiden ketjussa on myös quiraalihiiliatomi.
Tämän ominaisuuden vuoksi isoleusiinilla on neljä mahdollista tapaa: kaksi niistä on optisia isomeerejä, jotka tunnetaan nimellä L-isoleusiini ja d-isoleusiini ja kaksi muuta ovat L-isoleusiinin diastereoisomeerejä. Proteiinien hallitseva muoto on L-isoleusiini.
Isoleusiinin molekyylinen kaava on C6H13NO2 ja sen kemiallinen nimi on α-amino-β-metyyli-β-etyylipropioninen tai 2-amino-3-metyylipentatoninen happama tai happihappo.
Funktiot
Isoleusiinilla on useita fysiologisia toimintoja eläimissä, mukaan lukien
- Haavan paranemista
- Typpijätteen vieroitus
- Immuunitoimintojen stimulointi ja
- Eri hormonien erityksen edistäminen.
Sitä pidetään glykogeenisenä aminohappona, koska se toimii prekursorimolekyylinä sitrushapposyklin (Krebs -syklin) välittäjien synteesille, joka myöhemmin edistää glukoosin muodostumista maksassa.
Tästä syystä uskotaan, että isoleusiini osallistuu plasman glukoositasojen säätelyyn, jolla on tärkeitä vaikutuksia kehon energian kannalta.
Isoleusiini myötävaikuttaa glutamiinin ja alaniinin synteesireiteihin ja työskentelee haarautuneiden ketjun aminohappojen tasapainon hyväksi.
Jotkut kirjoittajat huomauttavat kliinisellä kentällä, että isoleusiinin, leusiinin, tyrosiinin ja valiiinin pitoisuuksien lisääntyminen voi olla tuumorin kärsivien solujen tyypillisiä markkereita, mitä seuraa glutamiinitasojen nousu.
Muut toiminnot
Erilaiset tieteelliset tutkimukset ovat osoittaneet, että isoleusiini on välttämätön hemoglobiinin synteesille, proteiinille, joka on vastuussa hapen kuljettamisesta monien eläinten veressä.
Lisäksi tämä aminohappo aktivoi ravinteiden pääsyn soluihin; Jotkut tutkimukset paljastavat, että pitkittyneen paaston aikana se kykenee korvaamaan glukoosin energian lähteenä ja lisäksi se on ketogeeninen aminohappo.
Se voi palvella sinua: biologian aikajanaKetogeeniset aminohapot ovat niitä, joiden hiilirungot voidaan varastoida, kuten rasvahapot tai hiilihydraatit, joten ne toimivat energiavarannossa.
Isoleusiini ja muut haarautuneet ketjun aminohapot (kasvutekijöiden ja ympäristöolosuhteiden lisäksi) työskentelevät rapamysiinin valkoisen tai kohde -signalointireitin, mTOR: n (englannista mTananistinen TAukko jompikumpiF R -Apamysiini-A.
Tämä reitti on tärkeä signalointireitti eukaryooteissa, jotka kykenevät hallitsemaan solujen kasvua ja aineenvaihduntaa, samoin kuin proteiinisynteesi- ja autofagiatapahtumia. Lisäksi se hallitsee ikääntymisen etenemistä ja joidenkin patologioiden, kuten syövän tai diabeteksen, etenemistä.
Biosynteesi
Ihmiset ja muut eläimet eivät pysty syntetisoimaan isoleusiinia, mutta tämä on osa soluproteiineja heidän hankkimisensa ansiosta päivittäin kuluttamastamme ruoasta.
Kasvit, sienet ja useimmat mikro -organismit kykenevät syntetisoimaan tämän aminohapon jonkin verran monimutkaisista reiteistä, jotka ovat yleensä yhteydessä toisiinsa muiden aminohappojen kanssa.
Aspartaatin, lysiinin, metioniinin ja treoniinin tuottamiseen on esimerkiksi tapoja tuottaa aspartaattia.
Erityisesti bakteereissa isoleusiini tuotetaan trooniiniaminohaposta pyruvaatin kautta reitin kautta, joka merkitsee pyruvaatin hiilihiilan kahden tiivistymistä α-ecthobutiraatin molekyylillä, joka johtuu treoniinista.
Reaktio alkaa entsyymidehydraasin vaikutuksella, joka katalysoi trooniinin kuivumista α-ekobutiraatin ja ammoniumin (NH3) tuottamiseksi (NH3). Myöhemmin samat entsyymit, jotka osallistuvat Valinin biosynteesiin, edistävät vaiheita
- Transaminaatio
- Vastaavien ketoasidien oksidatiivinen dekarboksylointi ja
- Dehydraus.
Tämän tyyppisissä mikro -organismeissa aminohappojen, kuten lysiinin, metioniinin, trooniinin ja isoleusiinin, synteesi on hyvin koordinoitu ja säännelty, etenkin negatiivisella palautteella, jossa reaktiotuotteet estävät kyseisten entsyymien aktiivisuutta.
Vaikka isoleusiini, kuten leusiini ja valiini, ovat ihmisille välttämättömiä aminohappoja, kehon kudoksissa olevat aminotransferae-entsyymit voivat kääntää ne käänteisesti vastaaviin α-Zo-Stoatteihin, jotka voivat lopulta korvata ne ruokavaliossa.
Heikkeneminen
Suurin osa luonteeltaan tunnetuista aminohapoista isoleusiini voidaan hajottaa muodostamaan erilaisia aineenvaihduntareittejä, joiden joukossa Krebs -sykli (joka tarjoaa suurimman määrän koentsyymejä, jotka toimivat energiantuotannossa tai muiden yhdisteiden biosynteesissä -A.
Sekä isoleusiini että tryptofaani, lysiini, fenyylialaniini, tyrosiini, treoniini ja leusiini voidaan käyttää asetyyli-CoA: n, keskeisen metabolisen välittäjän tuottamiseen useiden solureaktioiden suhteen.
Toisin kuin muut aminohapot, haarautuneet ketjun aminohapot (leusiini, isoleusiini ja valiini) eivät hajoa maksassa, vaan hapetetaan lihaksen, aivojen, munuaisten ja rasvakudoksen polttoaineiksi.
Nämä elimet ja kudokset voivat käyttää näitä aminohappoja aminotransferaasientsyymin läsnäolon ansiosta, jotka kykenevät toimimaan kolmeen ja tuottamaan vastaavan aminohappo α-zo.
Kun nämä hapettuneet aminohappiset johdannaiset ovat tuotettu, a-Zo-ketoasidinen entsymaattinen kompleksi katalysoi niiden oksidatiivista dekarboksylaatiota, missä se vapauttaa hiilidioksidimolekyylin (CO2) ja tuottaa kyseessä olevaa aminohappoja koskevan asyyli-COA-johdannaisen.
Isoleusiinin aineenvaihduntaan liittyvät patologiat
Isoleusiinin ja muiden aminohappojen metabolian viat voivat aiheuttaa omituisten ja monimutkaisten patologioiden monimuotoisuutta, kuten tauti ""Vaahterasiirappin virtsa”(Virtsa arce -siirappilla) tai haarautunut ketju ketoasiduria.
Kuten nimi viittaa, tälle taudille on ominaista siitä kärsivien potilaiden virtsan erottuva aromi oksentelun, kouristusten, henkisen vajaatoiminnan ja ennenaikaisen kuoleman lisäksi.
Sen on tehtävä erityisesti virheitä a-kethoacid-dehydrogenaasientsymaattisessa kompleksissa, joten haarautuneet ketjun aminohapot, kuten isoleusiini, ja sen hapettuneet johdannaiset erittyvät virtsaan.
Voi palvella sinua: Tafonomia: Historia, säilyttäminen ja fossiiliset muutoksetYhdessä haarautuneiden ketjun aminohappojen, kuten isoleusiinin, katabolismiin liittyvät patologiat tunnetaan orgaanisia happoja, vaikka ne, jotka liittyvät suoraan tähän aminohappoon, ovat melko harvinaisia.
Ruokia, joissa on rikas isoleusiinia
Tätä aminohappoa on runsaasti eläinten lihaskudoksissa, joten eläinperäiset lihat, kuten lehmä, sianliha, kalat ja muut vastaavat, kuten lammas, kana, kalkkuna, hirvieläimet, ne ovat rikkaat samassa.
Sitä löytyy myös meijeristä ja sen johdannaisista, kuten juusto. Se on munissa ja myös erityyppisissä siemenissä ja pähkinöissä, olennaisena osana niitä muodostavia proteiineja.
Sitä on runsaasti soijapapuissa ja herneissä, samoin kuin erilaisissa ruokatarkoituksiin käytetyissä hiivoissa.
Isoleusiinin plasmatasot aikuiselle ihmiselle ovat 30–108 μmol/l, 2–18 -vuotiaiden lapsille ja nuorille on välillä 22-107 μmol/L ja pikkulasten välillä 0–2 vuotta välillä 26 ja 86 μmol/L.
Nämä tiedot viittaavat siihen, että rikkaiden elintarvikkeiden kulutus tässä ja muissa liittyvissä aminohapoissa on välttämätöntä monien organismin fysiologisten toimintojen ylläpitämiseksi, koska ihmiset eivät pysty syntetisoimaan sitä Novo.
Saannisi edut
Ravitsemuslisäaineet isoleusiinilla sisältää yleensä muita haarautuneen ketjun välttämättömiä aminohappoja, kuten valine tai leusiini tai muu.
Yleisimpiä esimerkkejä isoleusiinin kulutuksesta ovat urheilijoiden käyttämät ravintolisät lihasmassan tai proteiinisynteesin prosenttimäärän lisäämiseksi. Tieteellistä perustaa, jolla näitä käytäntöjä tuetaan, keskustellaan jatkuvasti, eikä niiden tuloksia ole täysin taattu.
Isoleusiinia käytetään kuitenkin torjumaan potilaille, joilla on rikas durra- ja maissiruokavalio, joilla on runsaasti leusiinipitoisuutta, joilla on korkea leusiinipitoisuus, ja jotka voivat vaikuttaa tryptofaanin ja nikotiinihapon aineenvaihduntaan ihmisillä, joilla on rikas durra- ja maissiruokavalioiden metabolinen vaikutus.
Esimerkiksi pelagran vaikutukset kokeellisiin rottiin sisältyy kasvuviiveitä, jotka on voitettu isoleusiinin täydentämisellä.
- Eläintuotantoteollisuudessa
Eläintuotannon alueella on käytetty aminohappoja, kuten lysiiniä, treoniinia, metioniinia ja isoleusiinia.
Isoleuciinia näyttää siltä, että se on vaikuttanut typen assimilaatioon, vaikka se ei vaikuta näiden maatilan eläinten painonnousuun.
- Joissakin kliinisissä olosuhteissa
Jotkut julkaisut viittaavat siihen, että isoleusiini kykenee alentamaan plasman glukoositasoja, joten heidän saanninsa suositellaan potilaille, jotka kärsivät häiriöistä, kuten diabetestä tai alhaisesta insuliinintuotannosta.
Virusinfektiot
Isooleusiinilisäys on osoittautunut hyödylliseksi rotavirus -tartunnan saaneilla potilailla, jotka aiheuttavat sairauksia, kuten gastroenteriittiä ja ripulia pienillä lapsilla ja muilla nuorilla eläimillä.
Recent studies conclude that the consumption of this amino acid by experimental animals with the aforementioned characteristics (infected with rotavirus) help in the growth and performance of the innate immune system thanks to the activation of prr signaling routes or receptors with recognition of recognition of recognition of Kuviot.
Puutoshäiriöt
Puutto isoleusiinilla voi olla ongelmia visiossa, ihoissa (kuten ihottuma) ja suolistossa (ilmeisiä ripulina ja muina maha -suolikanavan oireina)).
Koska se on välttämätön aminohappo hemoglobiinin muodostumiselle ja synteesille sekä punasolujen (verisolujen) uudistamiselle, isoleusiinin vakavilla puutteilla voi olla vakavia fysiologisia seurauksia, erityisesti anemioihin ja muihin hematologisiin sairaudet.
Voi palvella sinua: tertiääriset kuluttajatTämä on osoitettu kokeellisesti ”normaaleilla” jyrsijöillä, joille on annettu huonoja ruokavalioita tässä isoleusiinissa, joka päättyy tärkeiden aneemisten maalauksien kehittymiseen.
Isoleusiini osallistuu kuitenkin hemoglobiinin muodostumiseen vain imeväisillä, koska aikuisen ihmisen proteiinilla ei ole tärkeitä määriä tällaista aminohappoa; Tämä tarkoittaa, että isoleusiinin puute on ilmeisempi kehitysvaiheissa.
Viitteet
- Aders Plimmer, R. (1908). Proteiinien kemiallinen perustuslaki. minä lähdin. Lontoo, Iso -Britannia: Longmans, Green ja CO.
- Aders Plimmer, R. (1908). Proteiinien kemiallinen perustuslaki. Osa II. Lontoo, Iso -Britannia: Longmans, Green ja CO.
- Barret, G., & Elmore, D. (2004). Aminohapot ja peptidit. Cambridge: Cambridge University Press.
- Blau, n., Duran, m., Blaskovics, M., & Gibson, K. (1996). Lääkärin opas metabolisten sairauksien laboratoriodiagnoosiin (2. painos.-A.
- Bradford, H. (1931). Aminohappojen löytämisen historia. II. Katsaus aminohappoihin, jotka on kuvattu vuodesta 1931 alkuperäisten proteiinien komponentteina. Edistykset proteiinikemiassa, 81-171.
- Campos-Ferraz, P. Lens., Bozza, t., Nicastro, H., & Vene,. H. (2013). Haarautuneen ketjun aminohapon (leusiini, isoleusiini ja valiini) -lisäaineisto-lisäravinteen selkeät vaikutukset väsymyksen vastustuskykyyn sekä lihaksen ja maksa-glykogeenin hajoamiseen koulutetuilla rotilla rotilla. Ravitsemus, 29(11-12), 1388-1394.
- Champe, P., & Harvey, R. (2003). Aminohapot aminohapot. Sisään Lippincottin kuvitetut arvostelut: biokemia (3. ed., pp. 1-12). Lippincott.
- Chandran, k., & Damodaran, M. (1951). Aminohapot ja proteiinit hemoglobiinin muodostumisessa 2. Isoleusiini. Lehden biokemiallinen, 49, 393-398.
- Chung, a. S., & Palkit, r. M. (1974). Lysiini-, treoniini-, metioniini- ja isoleusiini -täydentäminen Peace River -ohrasta kasvavien sikojen suhteen. Koira. J -. Anim. Sci., 436, 429-436.
- DeJong, c., Meijerink, w., Van Berlo, c., Deutz, n., & Soeters, P. (1996). Kasatut plasma -isoleusiinikeskukset ihmisen ylemmän maha -distrointial -verorraasin jälkeen. Suolisto, 39, 13-17.
- Edsall, J. (1960). Aminohapot, proteiinit ja syöpäbiokemia (Vol. 241). Lontoo: Academic Press, Inc.
- Britannica Encyclopaedia. (2012). Haettu 30. elokuuta 2019, https: // www.Britannica.com/tiede/isoleusiini
- Gelfand, r., Hendler, r., & Sherwin, R. (1979). Ruokavalion hiilihydraatti ja nautitun proteiinin aineenvaihdunta. Lancet, 65-68.
- Hudson, b. (1992). Ruokaproteiinien biokemia. Springer-Science+Business Media, B.V.
- Knerr, minä., Vockley, J., & Gibson, K. M. (2014). Leusiinin, isoleusiinin ja valiinin aineenvaihdunnan häiriöt. Majatalo. Blau (Ed.-A, Lääkärin opas perinnöllisten aineenvaihduntatautien diagnosoinnissa, hoidossa ja seurannassa (PP. 103-141).
- Korman, S. H. (2006). Isoleusiinin heikentymisen synnynnäiset virheet: Katsaus. Molekyyligenetiikka ja aineenvaihdunta, 89(4), 289-299.
- Krishnaswamy, k., & GPalan, C. (1971). Isoleusiinin vaikutus ihoon ja elektroenkefalogrammiin pellagrassa. Lancet, 1167-1169.
- Martin, r. JA., & Kirk, K. (2007). Esentiaalisten isoleusiinin kuljetus ihmisen punasoluissa, jotka ovat infektoituneet malarian loinen plasmodium falciparum. Veri, 109(5), 2217-2224.
- Kansallinen bioteknologiatietojen keskus. Pubchem -tietokanta. L-isoleusiini, CID = 6306, https: // Pubchem.NCBI.Nlm.NIH.Gov/Compend/L-isoleusiini (käytetty elokuussa. 31, 2019)
- Nuttall, f. Q -., Schweim, k., & Gannon, M. C. (2008). Oraalisesti annetun isoleusiinin vaikutus glukoosin kanssa ja ilman sitä insuliiniin, glukagoniin ja glukoosipitoisuuksiin ei-diabeetikoilla. Kliinisen ravitsemuksen ja aineenvaihdunnan eurooppalainen sähköinen kirja, 3(4), 152-158.
- Van Berlo, c. Lens. H., Van de Bogaard,. JA. J -. M., Van der Heijden, m. -Lla. H., Van Eijk, H. M. H., Janssen, M. -Lla., Bost, m. C. F., & Soeters, P. B -. (1989). On uskomaton ammoniakin vapauttaminen ruuansulatuskanavassa verenvuodon jälkeen? Tutkimus sikoissa. Hepatologia, 10(3), 315-323.
- Vickery, H. B -., & Schmidt, c. Lens. -Lla. (1931). Aminohappojen löytämisen historia. Kemialliset arvostelut, 9(2), 169-318.
- Wolfe, r. R -. (2017). Haarautuneiden ketjun aminit ja lihasproteiinisynteesi ihmisillä: myytti tai todellisuus? Kansainvälisen urheiluravinteen yhdistyksen lehti, 14(1), 1-7.
- Wu, g. (2009). Aminohapot: aineenvaihdunta, toiminnot ja ravitsemus. Aminohapot, 37(1), 1-17.
- « Teollisuusekologian historia, tavoitteet, esimerkit
- Fenyylialaniiniominaisuudet, toiminnot, biosynteesi, ruoka »

