Fenyylialaniiniominaisuudet, toiminnot, biosynteesi, ruoka
- 3426
- 470
- Eddie Hackett
Se Fenyylialaniini (Phe, F) on yksi yhdeksästä välttämättömästä aminohaposta, toisin sanoen ihmiskeho ei syntetisoi sitä endogeenisesti. Sivuketjussa tällä aminohapolla on ei -polaarinen aromaattinen yhdiste, joka on ominainen.
Tutkijat J tunnisti ensin fenyylialaniinin tai β-fenyyli-a-amino-propionihapon ensin vuonna 1879. H. Schulze ja M. Barbieri Fabaceae -perheen kasvista, joka tunnetaan nimellä Lupinus luteus tai "keltainen altramuz".
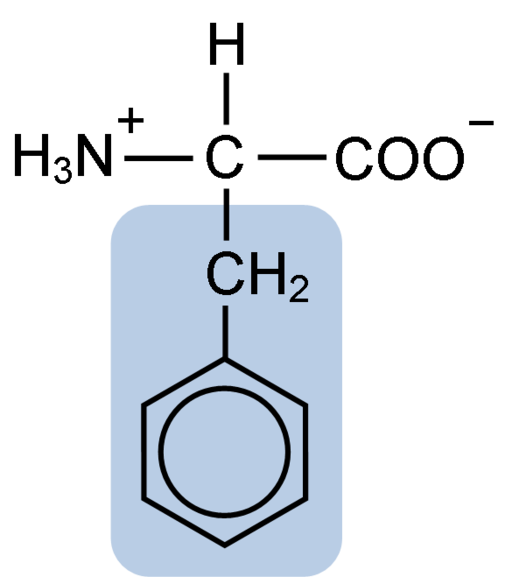
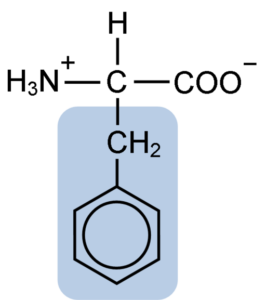 Aminohappofenyylialaniinin kemiallinen rakenne (lähde: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta)
Aminohappofenyylialaniinin kemiallinen rakenne (lähde: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta) DiPéptide L-fenyylialaniini-L-partilti tunnetaan nimellä aspartaami tai "NutraSweet", joka on makeutusaine, joka on tuotettu synteettisesti ja laajalti käytettyjä ravintoloissa ja kahviloissa, tyypillisesti makeuttamaan juomia, kuten kahvia, teetä, lemonadia ja muut juomat.
Lämmitetyissä ominaisuuksissa olevissa hedelmissä L-fenyylialaniinin muuntaminen fenoliestereissä, kuten eugenolissa ja sen metallisissa johdannaisissa, on se, joka aiheuttaa makean kukkakaasun tai samanlaisen kuin banaanien ja banaanien tyypillinen hunaja kypsyessä, kun kypsä.
Muodosta riippuen fenyylialaniinilla voi olla erilaisia makuja. Esimerkiksi L-fenyylialaniinimuodossa on makea aromi ja maku, kun taas D-fenyylialaniini on hiukan katkera ja yleensä Tood.
Koska sillä on vahva hydrofobinen luonne, fenyylialaniini on yksi monien luonnon hartsien, kuten polystyreenin, tärkeimmistä aineosista. Nämä hartsit, kun ne ovat kosketuksissa vesimolekyyleiden kanssa, muodostavat suojaavan tai peittorakenteen, joka tunnetaan nimellä "Clatrato".
Kasvitieteilijät käyttävät fenyylialaniinin biosynteesireitiä fenyylialaniinireitiä evoluutiokellona, koska on havaittu, että nämä liittyvät maanpäällisten kasvien morfologiseen monipuolistumiseen.
[TOC]
Ominaisuudet ja rakenne
Fenyylialaniini jakaa kaikkien aminohappojen kanssa karboksyyliryhmä (-COH), aminoheryhmä (-NH2) ja vetyatomi (-H), jotka on kiinnitetty keskushiiliatomiin, joka tunnetaan nimellä hiili-a. Lisäksi sillä on tietysti sivuketju tai ominainen R -ryhmä.
Fenyylialaniini on yksi kolmesta aminohaksosta, joilla on aromaattisia tai bentseenirenkaita substituentina sivuketjuissa. Nämä yhdisteet eivät ole polaarisia, ja siksi ne ovat erittäin hydrofobisia.
Kyseinen aminohappo on erityisen hydrofobinen, koska toisin kuin tyrosiini ja tryptofaani (kaksi muuta aminohappoa aromaattisilla renkailla) ei ole amino- tai hydroksyyliryhmiä, jotka ovat yhdistyneitä sen bentseenirenkaaseen.
Fenyylialaniinin aromaattisella, bentsooisella tai Sandylalaniiniryhmällä on tyypillinen bentseenirakenne: Syklinen rengas on rakennettu 6 hiiliatomilla, joilla on resonanssi niiden välillä kolmen kaksoissidoksen läsnäolon ja kolmen yksinkertaisen sidoksen läsnäolon vuoksi sisällä.
Toisin kuin tyrosiini ja tryptofaani, jotka voivat saada vastaavasti positiivisen ja negatiivisen kuorman, fenyylialaniini säilyttää neutraalin kuormansa, koska bentseenirengas ei ole ionisoitu ja karboksyyli- ja aminoryhmien kuormat neutraloivat toisiaan.
Luokittelu
Aminohapot luokitellaan eri ryhmiin niiden sivuketjujen tai R -ryhmien ominaisuuksien mukaan, koska niiden koko, rakenne, funktionaaliset ryhmät ja jopa sähkövarauksissa ne voivat vaihdella.
Kuten mainittiin, fenyylialaniini luokitellaan aromaattisten aminohappojen ryhmään sekä tyrosiinin ja tryptofaanin kanssa. Kaikilla näillä yhdisteillä on aromaattiset renkaat rakenteessaan, mutta tyrosiinilla ja tryptofaanilla on ionisoitavia ryhmiä heidän R -ryhmien substituenteissa.
Voi palvella sinua: Allopatrinen spesifikaatio: Konsepti, prosessi ja esimerkitProteiinin valon imeytymisominaisuudet 280 nm: n aallonpituudella johtuu fenyylialaniiniryhmässä luokiteltujen aminohappojen läsnäolosta, koska ne imevät helposti ultraviolettivalon aromaattisten renkaidensa läpi.
On kuitenkin osoitettu, että fenyylialaniini absorboi paljon vähemmän suhteessa kuin tyrosiini ja tryptofaani, joten joidenkin proteiinien analysoinnissa sen absorbanssi on ennustettavissa.
Stereokemia
Kaikissa aminohapoissa on keskeinen quiraalhiili, jolla on neljä yhtenäistä atomia tai ryhmää, ja kuten jo sanottiin, tämä atomi tunnistetaan hiiliksi α. Tämän hiilen perusteella voidaan löytää ainakin kaksi stereoisomeeriä jokaisesta aminohaksosta.
Stereoisomeerit ovat molekyylejä, joissa on spekulaarisia kuvia, joilla on sama molekyyl kaava, mutta jotka eivät ole päällekkäisiä toisiinsa, kuten esimerkiksi kädet ja jalat. Yhdisteet, jotka kiertävät kokeellisesti oikeaa polarisoitua valotasoa.
On tärkeää kommentoida, että ero D-fenyylialaniinin ja L-fenyylialaniinimuotojen välillä on avain tämän aminohapon aineenvaihdunnan ymmärtämiseen selkärankaisten kehossa.
L-fenyylialaniinimuoto metaboloituu ja hyödynnetään soluproteiinien rakentamiseen, kun taas verenkierrosta on löydetty D-fenyylialaniinia suojaavana aineena reaktiivisia happilajeja (ROS) vastaan.
Funktiot
90 -luvulla ajateltiin, että fenyylialaniini oli vain joissakin kasvilajeissa. Nykyään tiedetään, että sitä on läsnä melkein kaikissa proteiinien hydrofobisissa domeeneissa, fenyylialaniini on itse proteiinien aromaattisten kemiallisten lajien pääkomponentti.
Kasveissa fenyylialaniini on kaikkien proteiinien olennainen komponentti; Lisäksi se on yksi sekundaaristen metaboliittien, kuten fenyylipropanoidien (jotka ovat osa pigmenttejä) prekursoreista, puolustavien molekyylien, flavonoidien, biopolymeerien, kuten ligniinin ja suberiinin.
Fenyylialaniini on emäksinen rakenne, joka muodostaa monia neuronaalista homeostaasia ylläpitäviä molekyylejä, joiden joukossa ovat peptidit, kuten vasopressiini, melanotropiini ja enkefaliini. Lisäksi tämä aminohappo on suoraan mukana adrenokortooppisen hormonin synteesissä (ACTH).
Kuten suuri osa proteiinin aminohapoista, fenyylialaniini on osa ketogeenisten ja glukogeenisten aminohappojen ryhmä.
Kun fenyylialaniini muuttuu ylimääräisesti tyrosiiniksi ja myöhemmin fumaraatiksi, Krebs -syklin välittäjä.
Biosynteesi
Fenyylialaniini on yksi harvoista aminohapoista, joita useimmat selkärankaiset organismit eivät pysty syntetisoida. Tällä hetkellä vain biosynteettisiä reittejä tunnetaan tästä aminohaksosta prokaryoottisissa organismeissa, hiivoissa, kasveissa ja joissain sienilajeissa.
Synteesireitiltä vastaavat geenit ovat hyvin säilyneet kasvien ja mikro -organismien välillä, joten biosynteesillä on samanlaiset vaiheet melkein kaikissa lajeissa. Jopa joitain reitin entsyymejä on läsnä joissakin eläimissä, mutta nämä eivät kykene syntetisoimaan sitä.
Fenyylialaniinin biosynteesi kasveissa
Kasvilajeissa fenyylialaniini syntetisoidaan sisäisen metabolisen reitin kautta kloroplasteissa, jotka tunnetaan nimellä "predetenaattireiti". Tämä reitti liittyy metabolisesti "Shikimato-reittiin" L-arogenaton läpi, yksi jälkimmäisen aikana tuotetuista metaboliteista.
Voi palvella sinua: topoisomeraasi: mitkä ovat, ominaisuudet, toiminnot, tyypitInhyydratasa arewood -entsyymi katalysoi kolmivaiheista reaktiota, jossa se muuttaa aromaattisen renkaan fenyylialaniinin ominaiseksi bentseenirenkaksi.
Tämä entsyymi katalysoi transaminointia, kuivumista ja hajoamista.
Kloroplastien sisäpuolella olevan kertyneen fenyylipyruvaatin vieressä oleva ennalta (kloroplastien) vieressä voidaan muuntaa fenyylialaniiniksi reaktiolla katalysoimalla entsyymi -aminotransferaasin propenaattia, joka siirtää aminoryhmän fenyylipyruvaattiin siten, että se tunnistaa arogenaatin dehydraasia ja se on sisällyttänyt siihen, fenyylialaniinin synteesiin.
Joissakin lajeissa Pseudomonas Vaihtoehtoisia reittejä on kuvattu profenatolle, jotka käyttävät erilaisia entsyymejä, mutta joiden substraatit fenyylialaniinin synteesissä ovat myös predeenaatti ja arogenaatti.
Heikkeneminen
Fenyylialaniini voidaan metaboloida monin tavoin ruoasta. Suurin määrä tutkimuksia keskittyy määränpäähänsä keskushermosoluihin ja munuaiskudoksiin.
Maksa on fenyylialaniinin hajoamisen tai katabolismin tärkein elin. Hepatosyyteissä on entsyymi, joka tunnetaan nimellä hydroksylaasifenyylialaniini, joka kykenee muuttamaan fenyylialaniinia tyrosiiniksi tai yhdisteessä L-3,4-dihydroksifenyylialaniinia (L-DOPA).
L-DOPA-yhdiste on edeltäjä norepinefriinille, epinefriinille ja muille hormoneille ja peptideille, joilla on aktiivisuus hermostossa.
Fenyylialaniini voidaan hapettua aivosoluihin hydroksylaasityrosiinentsyymin avulla, joka vastaa fenyylialaniinin muuntamisen katalysoinnista dopakromiksi L-ASCorbiinihappojen läsnä ollessa.
Aikaisemmin ajateltiin, että hydroksylaasityrosiinihydroksylaasi -tyrosiini kuitenkin havaittiin kuitenkin, että tämä fenyylialaniini ja tyrosiinihydroksityyli samassa suhteessa ja fenyylianiinin hydroksylaatio estää tyrosiinin hydroksylaatiota.
Tällä hetkellä tiedetään, että suuret tyrosiinin osuudet estävät hydroksylaasityrosiinin entsymaattista aktiivisuutta, mutta sama ei pidä paikkaansa fenyylialaniiniin.
Fenyylialaniiniruoat
Kaikissa proteiinirikkaissa elintarvikkeissa on fenyylialaniinipitoisuus välillä 400 -700 mg nautitun ruoan osasta. Ruoat, kuten turskaöljy, tuore tonnikala, hummerit, osterit ja muut simpukka, sisältävät enemmän kuin 1.000 mg nautittujen ruokien annosta.
Naudan ja sianlihan fenyylialaniinitasot ovat myös korkeat. Ne eivät kuitenkaan ole niin korkeat kuin merieläimissä olevat pitoisuudet. Esimerkiksi pekonia, naudanlihaa, maksa-, kana- ja maitotuotteita on 700–900 mg fenyylialaniinia ruoan antamalla.
Pähkinät, kuten maapähkinöt ja erityyppiset pähkinät, ovat muita ruokia, joilla on hyvä määrä fenyylialaniinia. Jyvät, kuten soijapavut, kahviherneet ja muut palkokasvit, voivat tarjota 500–700 mg fenyylialaniinia annoksella.
Vaihtoehtoisena lähteenä fenyylialaniini voidaan metaboloida aspartaamista.
Saannisi edut
Fenyylialaniinia löytyy kaikista kuluttamiemme proteiinirikkaista ruuista. Aikuisten vähimmäiskulutus ja keskimääräinen koko on noin 1000 mg, joka on välttämätön proteiinisynteesille, hormoneille, kuten dopamiini, erilaisten välittäjäaineiden jne.
Se voi palvella sinua: mikä on maan luonnollinen monimuotoisuus?Tämän ylimääräisen aminohapon kulutus on määrätty ihmisille, joilla on masennushäiriöitä, nivelkipuja ja ihosairauksia, koska sen kulutus lisää proteiinin synteesiä ja välittää biomolekyylejä, kuten epinefriiniä, norepinefriiniä ja dopamiinia.
Jotkut tutkimukset viittaavat siihen, että liiallisessa määrin kulutettu fenyylialaniini ei tuota merkittäviä parannuksia missään näistä häiriöistä, vaan niiden muuntaminen tyrosiiniksi, jota käytetään myös signalointimolekyylien synteesiin, voi selittää positiiviset vaikutukset solusignaaliin hermostossa hermosto.
Ummetusta vastaan muotoillut lääkkeet ovat fenyylialaniinin, tyrosiinin ja tryptofaanin rakenteellisia ytimiä. Yleensä nämä lääkkeet sisältävät näiden kolmen aminohappon seoksia muodoissaan L-y d-.
Puutoshäiriöt
Verifenyylialaniinitasot ovat tärkeitä aivojen asianmukaisen toiminnan ylläpitämiseksi, koska fenyylialaniini, tyrosiini ja tryptofaani ovat substraatit erilaisten välittäjäaineiden kokoamiseksi.
Jotkut häiriöt suhtautuvat pikemminkin tämän aminohapon aineenvaihdunnan alijäämiin, mikä tuottaa ylimääräisen sen puutteen sijasta.
Fenyylisetonuria, epätavallinen perinnöllinen sairaus naisilla, vaikuttaa fenyylialaniinin maksan hydroksylaatioon ja tekee kyseisen aminohapon liiallisen plasmatasoista, joten hermosolujen apoptoosi indusoituu ja vaikuttaa aivojen normaaliin kehitykseen.
Jos fenyylisetonuriasta sairastunut nainen tulee raskaaksi, sikiö voi esitellä niin kutsutun "hyperfenyylialaninemian äitien" sikiön oireyhtymää ".
Tämä johtuu siitä, että sikiöllä on korkeat fenyylialaniinipitoisuudet veressä (melkein kaksinkertainen standardit), joiden alkuperä liittyy sikiön maksa -hydroksylaasifenyylialaniiniin, joka kehittyy vasta 26 raskausviikon aikana raskausviikkoa vasta raskausviikoilla, joita raskausviikko.
Sikiön oireyhtymä, jolla.
Viitteet
- Biondi, R., Brancorsini, s., Poli, G., Egidi, m. G., Capodicasa, E., Bottoglieri, L.,… & Micu, r. (2018). Hydroksyyliradikaalin havaitseminen ja poisto D-fenyylialaniinihydroksylaatiolla ihmisen nesteissä. Talanta, 181, 172-181
- Cho, m. H., Korea, O. R -., Yang, h., Bedgar, d. Lens., Laskar, D. D -d., Anterola, a. M.,… & Kang, c. (2007). Fenyylialaniinin biosynteesi Thalian Arabidopsis Argenaatti -dehydraattien tunnistaminen ja ominaisuus. Journal of Biological Chemistry, 282 (42), 30827-30835.
- Fernstrom, J. D -d., & Fernstrom, M. H. (2007). Tyrosiini-, fenyylialaniini- ja katokolamiinisynteesi ja toiminta aivoissa. The Journal of Nutrition, 137 (6), 1539S-1547s.
- Hou, j., Vázquez-González, M., Fadeev, m., Liu, x., Lavi, r., & Willner, I. (2018). L-tyrosiinin ja L-fenyylialaniinin katalysoitu ja sähkökatalysoitu hapettuminen dopakromiin nanotsyymeillä. Nano Letters, 18 (6), 4015-4022.
- Nelson, D. Lens., Lehninger, a. Lens., & Cox, M. M. (2008). Lehninger -biokemian periaatteet. Macmillan.
- Perkins, r., & Vaida, V. (2017). Fenyylialaniini lisää kalvon läpäisevyyttä. Journal of American Chemical Society, 139 (41), 14388-14391.
- Plimmer, r. H. -Lla. (1912). Proteiinien kemiallinen perustuslaki (VOL. 1). Longmans, vihreä.
- Tensley, G. (2018). Terveyslinja. Haettu 5. syyskuuta 2018, www.Terveyslinja.com/ravitsemus/fenyylialaniini
- Tohge, t., Watanabe, m., Hoefgen, r., & Fernie,. R -. (2013). SHIKILIMA- JA FENYLALANIININ BIOSYNTESESI VIHREÄN SUUNNAA. Kasvitieteen rajat, 4, 62.
- « Isoleusiinin ominaisuudet, toiminnot, biosynteesi, ruoka
- Kansalliset etuominaisuudet, tavoitteet, presidentit »

