LDH -toiminnot, määritys, reaktio, normaalit arvot
- 1886
- 359
- Kelly Kilback
Se laktaattidehydrogenaasi, Maitohappojen dehydrogenaasi, laktaattista NAD-riippuvainen riippuvainen riippuvainen riippuvainen riippuvainen riippuvainen riippuvainen DeveLia tai yksinkertaisesti LDH on entsyymi, joka kuuluu Oxidorticas-ryhmään, jota löytyy käytännössä kaikissa eläinkudoksissa, vihanneksissa ja monissa mikro-organismeissa, kuten bakteereissa, hiivoissa ja kaareissa.
Tämän tyyppiset entsyymit merkitään lukumäärällä EC 1.1.1.Entsymaattisen nimikkeistön komitean 27 ja vastaa reaktiosta, joka muuttaa laktaatin pyruvaatiksi (hapettumisella) ja päinvastoin (pelkistämällä), hapettaa tai pelkistää adeniinin nikotiinamidin (NAD+ ja NADH) dyukleotideja prosessissa, joka tunnetaan Laktisen fermentoinnin yhteydessä.
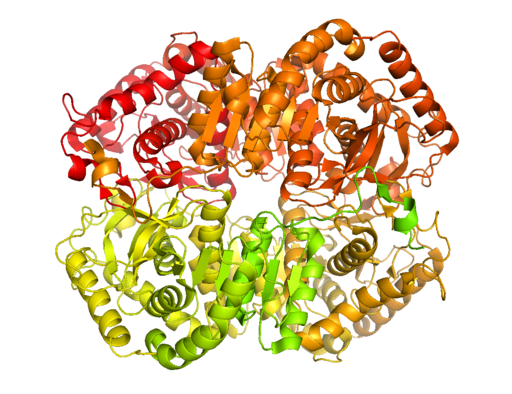
 Laktaattidehydrogenaasin B kiteinen rakenne (lähde: bcdoye [cc by-sa 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Wikimedia Commonsin kautta)
Laktaattidehydrogenaasin B kiteinen rakenne (lähde: bcdoye [cc by-sa 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Wikimedia Commonsin kautta) Toisin kuin alkoholinen käyminen, jota esiintyy vain joissakin mikro -organismeissa, kuten hiivoissa ja.
Tämä tärkeä entsyymi solujen aineenvaihdunnalle kiteytettiin luuston rotan lihaksesta 1940 -luvulla, ja tähän päivään mennessä parhaiten karakterisoidut ovat luurankojen lihakset ja sydänkudokset nisäkkäissä.
"Ylivoimaisissa" eläimissä entsyymi käyttää laktaatti L-isomeeriä (L-laktaatti) pyruvaatin tuotantoon, mutta jotkut ”alemmat” eläimet ja bakteerit tuottavat d-laktaattia glykolyysillä saatusta pyruvaatista.
Laktaattidehydrogenaasi ekspressoituu yleensä enimmäkseen kudoksissa tai soluissa anaerobisissa olosuhteissa (alhainen veren kastelu), jotka esimerkiksi ihmisillä voidaan karakterisoida patologisia olosuhteita, kuten syöpä-, maksa- tai sydämen olosuhteita.
Pyruvaatin muuntaminen laktaattiksi on kuitenkin tyypillistä lihaksille harjoituksen aikana ja silmän sarveiskalvo, joka on huonosti hapetettu.
[TOC]
Funktiot
Laktaattidehydrogenaasi täyttää useita toimintoja lukuisilla aineenvaihduntareiteillä. Se on hiilihydraattien katabolisten ja anabolisten reittien välisen herkän tasapainon keskipiste.
Aerobisen glykolyysin aikana pyruvaatti (reitin viimeinen tuote sinänsä) Sitä voidaan käyttää entsymaattisen kompleksisen pyruvaattidehydrogenaasin substraattina, jonka avulla se on dekarboksyloitu, vapauttaen asetyyli-CoA-molekyylejä, joita käytetään alavirran, metabolisesti ottaen Krebs-syklissä.
Anaerobisessa glykolyysissä päinvastoin, glykolyysin viimeinen vaihe tuottaa pyruvaattia, mutta laktaattidehydrogenaasi käyttää tätä laktaatin ja NAD: n tuottamiseksi ja NAD+, Se palauttaa nad+ jota käytettiin reaktion aikana, jota katalysoi glyseraldehydi 3-fosfaattidehydrogenaasi.
Kuten anaerobioosin aikana ATP: n muodossa olevien energiantuotannon tärkein lähde on glykolyysi, laktaattidehydrogenaasilla on perustavanlaatuinen rooli glykolyyttisen reitin aiemmissa vaiheissa tuotetun NADH: n reoksidoinnissa, välttämätöntä muiden asiaan liittyvien entsyymien toiminnalle.
Voi palvella sinua: tubuliiniLaktaattidehydrogenaasi osallistuu myös glykogeneesiin, joka tapahtuu kudoksissa, jotka muuttavat laktaattia glykogeeniksi, ja joissakin aerobisissa kudoksissa, kuten sydän, laktaatti on polttoaine, joka on uudelleenoksitutettu energian tuottamiseksi ja ATP: n ja NAD: n muodossa tehostamiseksi ja vähentämiseksi ATP: n muodossa ATP: n ja NAD: n muodossa+, vastaavasti.
Ominaisuudet ja rakenne
Laktaattidehydrogenaasin on useita molekyylimuotoja. Vain eläimissä on määritetty, että on viisi aktiivisuutta laktaattidehydrogenaasia, kaikki tetrameeriset ja koostuvat olennaisesti kahden tyyppisistä polypeptidiketjuista, jotka tunnetaan nimellä H ja M (kyky olla homo- tai heterotramérica)).
H -muoto on tyypillisesti sydämen kankaalla, kun taas M -muoto on havaittu luuston lihaksessa. Molemmat ketjut eroavat toisistaan runsauden, aminohappokoostumuksen, kineettisten ominaisuuksien ja rakenteellisten ominaisuuksien suhteen.
H- ja M -muodot ovat eri geenien translaatiotuote, jotka mahdollisesti sijaitsevat eri kromosomeissa ja jotka ovat myös eri geenien kontrollissa tai säätelyssä. H -muoto on hallitseva kudoksissa, joilla on aerobinen aineenvaihdunta ja M -muodossa anaerobisissa kudoksissa.
Toinen nimikkeistötyyppi käyttää kirjaimia A, B ja C erityyppisiin entsyymeihin sekä nisäkkäissä että lintuissa. Siten laktaattihydrogenaasi tunnetaan nimellä4, sydän4 ja kolmasosa kutsutaan c4, joka on spesifinen kivekselle.
Näiden isoentsyymien ekspressiota säädetään sekä kehityksestä riippuvan että kudoksesta riippuvaisen muodossa.
Entsyymi on eristetty eri eläinlähteistä ja on määritetty, että sen tetrameerisen rakenteen keskimääräinen molekyylipaino on noin 140 kDa ja että NADH: n tai NAD: n ammattiliittokohdan+ Se koostuu β-verkosta, joka koostuu kuudesta ketjusta ja 4 alfa-potkurista.
Päättäväisyys
Spektrofotometrialla
Eläinperäisen laktaattiaktiivisuuden dehydrogenaasi on tietty spektrofotometrisesti In vitro Värinvaihtomittausten kautta laktaattisen pyruvaatin muuntamisreaktion aikana tapahtuvan hapettumisprosessin ansiosta.
Mittaukset tehdään 340 nm: ssä spektrofotometrillä ja NADH: n hapettumisen tai ”katoamisen” johtuvan optisen tiheyden vähenemisnopeus, joka muunnetaan NAD: ksi+.
Eli määritetty reaktio on seuraava:
Pyruvate + nadh + h+ → laktaatti + nad+
Entsymaattinen mittaus tulisi suorittaa optimaalisissa pH -olosuhteissa ja substraattien pitoisuuksissa entsyymille, jotta näytteissä esiintyvän määrän aliarviointiriski substraatin alijäämän tai happamuuden tai emäksen äärimmäisten olosuhteiden vuoksi ei ole käynnissä.
Immunohistokemia
Toinen menetelmä, ehkä hieman nykyaikaisempi, laktaattidehydrogenaasin läsnäolon määrittämiseksi liittyy immunologisten työkalujen käyttöön, ts. Vasta -aineiden avulla.
Voi palvella sinua: homologia (biologia)Nämä menetelmät hyödyntävät antigeenin liiton välistä affiniteettia vasta -aineen kanssa, joka on syntynyt spesifisesti sitä vastaan ja ovat erittäin hyödyllisiä entsyymien, kuten LDH: n läsnäolon tai puuttumisen nopeaan määrittämisessä, tietyssä kankaassa.
Tarkoituksesta riippuen käytettyjen vasta -aineiden on oltava spesifisiä minkä tahansa isoentsyymin havaitsemiseksi tai mille tahansa proteiinille, jolla on laktaattiaktiivisuus dehydrogenaasi.
Miksi määrittää dehydrogenaasin laktaatti?
Tämän entsyymin määrittäminen suoritetaan eri tarkoituksiin, mutta lähinnä joidenkin tilojen kliiniseen diagnoosiin, mukaan lukien sydäninfarkti ja syöpä.
Solutasolla dehydrogenaasilaktaatin vapautumista on pidetty yhtenä parametreista nekroottisten tai apoptoottisten prosessien esiintymisen määrittämiseksi, koska plasmamembraani muuttuu läpäiseväksi.
Reaktion tuotteet, joita katalysaattorit voidaan määrittää myös kankaassa, jotta voidaan määrittää, onko anaerobinen aineenvaihdunta hallitseva jostakin erityisestä syystä.
Reaktio
Kuten alun perin kommentoi, entsyymi laktaattidehydrogenaasi, jonka systemaattinen nimi on (S) -LACTATO: NAD+ dehydrogenaasi, katalysoi laktaattimuunnos pyruvaatiksi+ riippuvainen tai päinvastoin, joka tapahtuu hydridi -ionin siirron ansiosta (H-) Pyruvaatista laktaattiin tai NADH: sta hapetettuun pyruvaattiin.
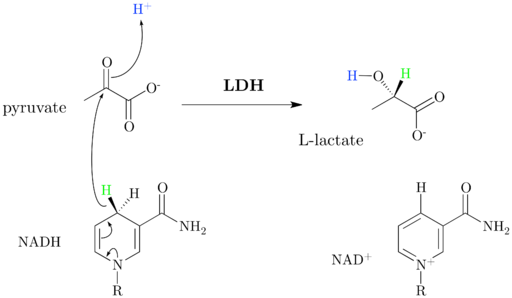 Dehydrogenaasilaktaatin kaavio ja reaktiomekanismi (lähde: jazzlw [CC BY-Sa 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta)
Dehydrogenaasilaktaatin kaavio ja reaktiomekanismi (lähde: jazzlw [CC BY-Sa 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta) Nad+ Siinä on ADP3, Ja tämä koentsyymi osallistuu moniin reaktioihin, joilla on suuri biologinen merkitys.
On tärkeää korostaa, että tämän reaktion tasapaino on siirretty laktaattia vastaavalle sivulle ja on osoitettu, että entsyymi kykenee myös hapettamaan muita happoja (S) -2 -hydroksimonokarboksyyli ja käyttö, vaikkakin vähemmän tehokkaasti, NADP+ substraattina.
Riippuen kehon alueesta, joka on otettu huomioon ja samalla sen metaboliset ominaisuudet suhteessa hapen esiintymiseen tai puuttumiseen, kudokset tuottavat erilaisia määriä laktaattia, LDH: n katalysoiman reaktion tuote.
Jos esimerkiksi punasolu (erytrosyytti), josta puuttuu mitokondrioita, jotka voivat metaboloida glykolyysin aikana tuotettua pyruvaattia CO: lle2 Ja vettä, sitten voitaisiin sanoa, että nämä ovat tärkeimmät laktaattia, joka tuottaa soluja ihmiskehossa, koska kaikki pyruvaatti muuttuu laktaatiksi dehydrogenaasilaktaatin vaikutuksella.
Toisaalta, jos otetaan huomioon luustolihasten maksasolut ja solut, nämä ovat vastuussa vähimmäismäärän laktaattia, koska tämä metaboloituu nopeasti.
Voi palvella sinua: Sabouraud Agar: Mikä on, perusta, valmistelu, käyttöNormaalit arvot
Laktaattidehydrogenaasin pitoisuus veren seerumissa on useiden isoentsyymien ilmentymisen tuote maksassa, sydämessä, luurankoissa, punasoluissa ja kasvaimissa, muun muassa.
Veriserumissa dehydrogenaasilaktaatin normaalit aktiivisuusalueet ovat välillä 260 - 850 U/ml (yksiköt millilitraa kohti), keskiarvo 470 ± 130 U/ml. Samaan aikaan verihemoralisoituneilla on LDH -aktiivisuus, joka vaihtelee välillä 16.000 ja 67.000 u/ml, joka vastaa keskimäärin 34.000 ± 12.000 u/ml.
Mitä tarkoittaa korkea LDH?
Laktaattidehydrogenaasin konsentraation kvantifiointi veren seerumissa on tärkeä arvo jonkin sydämen, maksan, verisairauksien ja jopa syöpien diagnoosissa.
Korkeat LDH -aktiivisuusluvut on löydetty potilailla, joilla on sydäninfarktit (sekä kokeellinen että kliininen), samoin kuin syöpäpotilailla, erityisesti naisilla, joilla on endometriumisyöpä, munasarjat, rinnat ja kohtuut.
Erityisestä isoentsyymistä riippuen, joka on ”ylimääräisessä” tai korkeassa pitoisuudessa, monet hoitavat lääkäreitä käyttävät dehydrogenaasilaktaatin isoentsyymien kvantifiointia kudoksille (vakava tai krooninen) aiheuttamien vammojen määrittämiseksi (vakava tai krooninen).
Viitteet
- Bergmeyer, H., Taivutettu, e., & Hess, b. (1961). Maito -dehydrogenaasi. Entsymaattisen analyysin menetelmät. Seelag Chemie, GmbH.
- Chung, f., Tsujubo, h., Bhattacharyya, u., Sharief, f., & Li, s. (1985). Ihmisen laktaattidehydrogenaasi-A-geenin genominen organisointi. Lehden biokemiallinen, 231, 537-541.
- Becker, D. (2003). Maitohappo. Intensiivinen hoito, 29, 699-702.
- Jopa J., & Kaplan, N. (1973). Laktaatin dehydrogenssit: rakenne ja toiminto. Sisään Entsymologian edistysaskeleet ja niihin liittyvät molekyylibiologian alueet (PP. 61-133).
- Kettu, s. Yllyttää. (2006). Ihmisen fysiologia (9. painos.-A. New York, USA: McGraw-Hill Press.
- Huijgen, h., Sanders, G. T. B -., Koster, r. W -., Vreeken, J., & Bossuyt, P. M. M. (1997). Laktaatidehydrogenaasin kliininen arvo seerumissa: kvantitatiivinen katsaus. Eur J Clin Chem Clin Biochem, 35(8), 569-579.
- Kansainvälisen biokemian ja molekyylibiologian kansainvälisen liiton nimikkeistökomitea (NC-IBMB). (2019). Haettu www.Qmul.Ac.UK/SBCS/IUBMB/Entsyymi/Hakemisto.HTML
- Rawn, j. D -d. (1998). Biokemia. Burlington, Massachusetts: Neil Patterson Publishers.
- USAGUI-Gomez, M., Wicks, r. W -., & Warshaw, M. (1979). Laktaattidehydrogenaasin (LDH1) sydämen isoentsyymin immunokemiallinen määritys ihmisen seerumissa. Clin Chem, 25(5), 729-734.
- Wróblewski, f., & Ladue, J. S. (1955). Maito -degydrogenaasiaktiivisuus veressä. Kokeellinen biologia ja lääketiede, 90, 210-215.
- « Páramo -ominaisuudet, tyypit, kasvisto, eläimistö, esimerkit
- Apolipoproteiini ja ominaisuudet, toiminnot, sairaudet »

