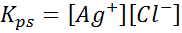Massatoimintalaki

- 3545
- 922
- Alonzo Kirlin
 Sademääräreaktio sisältää liukoisuuden tasapainon, jota hallitsee massatoimenpiteet
Sademääräreaktio sisältää liukoisuuden tasapainon, jota hallitsee massatoimenpiteet Mikä on joukkokantolaki?
Se Massatoimintalaki toteaa, että reaktion nopeus riippuu sen reagenssien pitoisuudesta, joka on nostettu sen stökiometrisiin kertoimiin. Tämä laki sallii suhtautua toisiinsa palautuvan kemiallisen reaktion reagenssien ja tuotteiden pitoisuuksien pitoisuudet. Toisin sanoen se määrittelee tasapainovakion kaavan.
Norjalaiset (ja kerma) kemistit Cato m. Guldberg (1836-1902) ja Peter Waage (1833-1900) vuonna 1864. Tämä on yksi kemian peruslakeista, koska se antaa meille mahdollisuuden laskea tasapainon lopulliset pitoisuudet alkuperäisistä määristä.
Tämän lisäksi massalaki antaa meille mahdollisuuden ymmärtää helposti minkä tahansa lajin pitoisuuksien muutosten vaikutukset tasapainoon. Toisin sanoen se antaa meille mahdollisuuden ymmärtää, kuinka Le Chatlierin periaatteet toimivat.
Huolimatta siitä, että sitä kutsutaan "joukkotoimenpiteisiin", se ei oikeastaan viittaa reagenssien ja tuotteiden massoihin, vaan pikemminkin niiden pitoisuuksiin. Syy, jota kutsutaan joukkotutkimukseksi eikä pitoisuuksien toimintalaki, on se, että pitoisuutta kutsutaan "aktiiviseksi massaksi".
Massatoimenpiteen laki ja tasapainovakio
Massatoimenpiteen lain mukaan, kun palautuvat reaktiot saavuttavat tasapainon, se ei johdu siitä, että reaktio pysähtyy. Päinvastoin, tasapaino saavutetaan, kun suoran reaktion nopeus tehdään yhtä suuri kuin käänteisen reaktion nopeus. Kun näin tapahtuu, kaikki kemialliset lajit esiintyvät ja kulutetaan samalla nopeudella, joten niiden pitoisuudet muuttuvat (ne lopettavat vaihtamisen).
Voi palvella sinua: Tolueeeni: rakenne, ominaisuudet, käytöt, hankkiminenGuldberg ja Waage havaitsivat, että molempien reaktioiden (suorat ja käänteiset) nopeudet riippuvat molaarisesta pitoisuudesta (mol/l) niiden reagensseihin, jotka on korotettu stökiömetrisiin kertoimiin. Näistä havainnoista he onnistuivat löytämään kaavan tasapainon vakiona.
Tämän lain mukaan kaikki palautuva kemiallinen reaktio, joka saavuttaa tasapainon,
”… Stoikiometrisiin kertoimiin nostettujen tuotteiden molaaristen pitoisuuksien ja niiden stöktiometristen aineiden molaaripitoisuuksien välinen suhde, joka on nostettu niiden stökiikometrisiin kertoimiin, on vakio tietyssä lämpötilassa."
Tätä vakiona kutsutaan "tasapainon vakiona" ja sitä esitetään K -symbolillac.
Tasapainon vakiokaava
Katsotaanpa, kuinka edellinen lausunto näyttää matemaattisen yhtälön muodossa. Se on palautuva kemiallinen reaktio, kuten jäljempänä esitetty, missä A ja B ovat reagensseja, C ja D tuotteet ja A, B, C ja D ovat tasapainoisen reaktion vastaavat stökiometriset kertoimet:
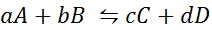
Tällaisen yleisen reaktion suhteen tasapainovakio annetaan:
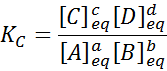
Jos [A], [B], [C] ja [D] ovat a, b, c ja d molaarisia pitoisuuksia tasapainossa.
Tasapaino vakio paineissa
Tasapainovakion aikaisempi kaava koskee kaikkia kemiallisia reaktioita, joissa kaikki aineet ovat samassa vaiheessa (ts. Eli ne kaikki ovat vesifaasissa tai esimerkiksi kaasufaasissa). Kaasuheafaasireaktioiden tapauksessa on kuitenkin helpompaa työskennellä paineiden kanssa kuin pitoisuuksilla.
Koska kaasujen molaaripitoisuus on verrannollinen niiden osittaiseen paineeseen, niin tasapainovakion kaava voidaan kirjoittaa uudelleen näiden paineiden perusteella seuraavasti:
Se voi palvella sinua: 30 karboksyylihappojen käyttöä arjessa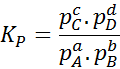
Missä p-Lla, pB -, pC Ja pD -d Ne ovat vastaavasti A: n, B: n ja D: n ja D: n, B: n ja D: n osittaiset paineet. Tässä tapauksessa kP Sitä kutsutaan jatkuvan tasapainon paineissa, ja se liittyy k: äänC Seuraavan kaavan kautta:
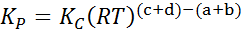
missä R on ihanteellisten kaasujen yleinen vakio ja T on Kelvinin absoluuttinen lämpötila.
Reaktiot, joihin liittyy useampi kuin yksi vaihe
Joskus kemiallinen reaktio sisältää kiinteän aineen muodostumisen saostumana liuoksesta tai nesteen muodostuminen reagensseista, jotka reagoivat kaasufaasissa. Näissä tapauksissa reaktiota ei tapahdu samassa vaiheessa, joten meidän on muokattava tasapainon vakiokaava.
Onneksi muutokset ovat hyvin yksinkertaisia. Ainoa asia, joka meidän on otettava huomioon kirjoittaessasi tasapainovakion kaavaa, on, että kiinteiden aineiden tai nesteiden puhtaan aineen ei pitäisi ottaa niitä huomioon. Tarvittaessa asetamme sen sijaan 1.
Yhteenvetona voidaan todeta, että massatoimintalaki sallii kirjoittaa tasapainovakion kaavan sekä pitoisuuksissa että osittaisissa paineissa. Kun tiedät yhden kahdesta, toinen löytyy ensimmäisestä.
Lopuksi meidän on oltava varovaisia ja tarkistettava vaihe, jossa kaikki kemialliset lajit löytyvät.
Esimerkkejä massatoimenpiteen käytöstä
Seuraavissa esimerkeissä osoitamme, kuinka massatoimintalaki käytetään tasapainovakioiden kaavojen kirjoittamiseen erityyppisille kemiallisille reaktioille.
Reaktioiden reaktiot kaasumaisessa tilassa
Esimerkki 1: N: n hajoaminen2JOMPIKUMPI4 kaasufaasissa
N2JOMPIKUMPI4 Se on ruskea kaasu, joka hajoaa seuraavan reaktion mukaan:
Se voi palvella sinua: Láuriinihappo: rakenne, ominaisuudet, käytöt, edut, vaikutukset
 NO2 -näyte eri lämpötiloissa, jotka osoittavat tasapainon siirtymisen ruskeaan N2O4
NO2 -näyte eri lämpötiloissa, jotka osoittavat tasapainon siirtymisen ruskeaan N2O4 Tätä reaktiota varten pitoisuuksien ja paineiden tasapainovakiot annetaan:
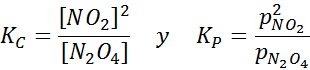
Esimerkki 2: Hiilimonoksidin hapettuminen
Hiilimonoksidi on erittäin myrkyllinen kaasu, josta voi tulla hiilidioksidia reagoidessaan hapen kanssa seuraavan reaktion mukaan:
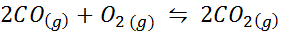
Tätä reaktiota varten pitoisuuksien ja paineiden tasapainovakiot annetaan:
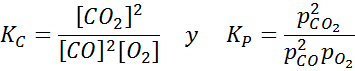
Happo-emäs tasapainotus vesifaasissa
Esimerkki 3: Veden itsepituus
Veden ioninen tasapaino, joka tunnetaan myös nimellä veden itsenpituusreaktio, on palautuva reaktio kahden vesimolekyylin välillä nestemäisessä tilassa. Reaktio on:
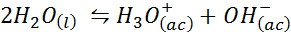
Kun kirjoitat tämän reaktion tasapainoa vakiona, meidän on otettava huomioon, että tässä tapauksessa ainoa reagenssi on puhdas neste, jonka pitoisuus on käytännössä vakio. Tästä syystä sitä ei sisälly tasapainon vakiona:
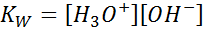
Tämä on erittäin tärkeä tasapainovakio, joka vastaanottaa oman nimensä (veden vakio) ja oman symbolin (kW -. W viittaa veteen englanniksi, joka sanotaan WC-A. Se on kuitenkin tasapainon tasapaino pitoisuuksissa, kuten minkä tahansa muun.
Liukoisuus tasapainotus
Esimerkki 4: Hopeakloridin liukoisuustasapaino
Kun valmistelemme tyydyttyneen liuoksen, liukoisuustasapaino on muodostettu. Tässä tapauksessa tasapaino on hopeakloridin liukeneminen, jonka reaktio saadaan:
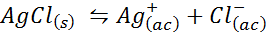
Tämän reaktion (ja kaikkien liuosreaktioiden) tasapainovakio ei sisällä hopeakloridia (AGCL), koska se on kiinteä. Lisäksi, kuten veden tapauksessa, nämä vakiot saavat myös erityisen nimen, joka on ”liukoisuustuotteen vakio”, edustettuna k$-