Kaksinkertainen korvausreaktio
- 2462
- 698
- Dr. Travis Reichert
Selitämme, mikä on kaksinkertainen korvausreaktio, tyypit, jotka ovat olemassa ja annamme useita esimerkkejä
Mikä on kaksinkertainen korvausreaktio?
Se kaksinkertainen korvausreaktio, Kaksinkertainen siirtymä tai metesisi, se on yksi, jossa ionien kaksoisvaihto tapahtuu kahden yhdisteen välillä ilman mitään näistä hapettuneita tai vähentyneitä. Se muodostaa yhden alkeisimmista kemiallisista reaktioista.
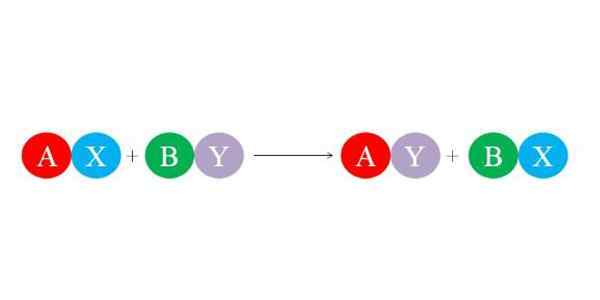
Uudet linkit muodostavat suuret sähköstaattiset vetovoimat ionien välillä. Samoin reaktio suosii stabiilimpien lajien, kuten vesimolekyylin, muodostumista. Alemmassa kuvassa havainnollistetaan yleinen kemiallinen yhtälö kaksoissubstituutioreaktiolle.

Alkuperäiset yhdisteet kirves ja reagoimalla vaihtamalla "heidän kumppaninsa" ja muodostavat siten kaksi uutta yhdistettä: AY ja BX. Tämä reaktio toimii vain ja vain jos E ja ovat enemmän toisiinsa kuin A ja B, tai jos BX -linkit ovat vakaampia kuin. Koska reaktio on yksinkertainen ioninvaihto, mikään näistä voitoista ei menetä elektroneja (redox -reaktio).
Siten, jos A on kuorman kationi +1 AX -yhdisteessä, sillä on sama kuorma +1 yhdisteessä AY. Sama pätee muihin "kirjaimiin". Tämäntyyppinen reaktio on happo-emäs- ja saostusmuodostusreaktioiden tuki.
Kaksoiskorvikkeiden reaktiotyypit
Neutralointi
Vahva happo reagoi vahvan emäksen kanssa liukoisten suolojen ja veden tuottamiseksi. Kun toinen kahdesta - happo tai emäs - on heikko, tuotettu suola ei ole täysin ionisoitu; eli vesipitoisessa väliaineessa, joka kykenee hydrolysoimaan. Samoin happo tai emäs voidaan neutraloida suolalla.
Voi palvella sinua: berylioksidi (BEEO)Yllä olevaa voidaan edustaa uudelleen kemiallinen yhtälö Axby -kirjaimilla. Koska Brønstedin happamuus on kuitenkin merkitty vain H -ioneilla+ ja oh-, Nämä tulevat edustamaan kirjeitä e y:
Hx + boh => hoh + bx
Tämä kemiallinen yhtälö vastaa neutralointia, joka on yksinkertaisesti reaktio HX -hapon ja BOH -emäksen välillä HOH: n tuottamiseksi (H2O) ja BX -suola, joka voi hyvinkin olla liukoinen tai ei vedessä.
Stoikiometristen kertoimien tai hapon luonteen mukaan luuranko voi vaihdella (orgaaninen tai epäorgaaninen).
Sademäärä
Tämän tyyppisessä reaktiossa yksi tuotteista on liukenematon keskellä, yleensä vesipitoisia ja saostuu (sedimentit muun liuoksen kiinteä kiinteä).
Järjestelmä on seuraava: kaksi liukoista yhdistettä, AX ja By, sekä yksi tuotteista, AY tai BX, Sackite, mikä riippuu liukoisuussäännöistä:
AX + BY => AY (S) + BX
Ax + by => ay + bx (s)
Jos sekä AY että BX olivat liukenemattomia veteen, se saostaa, että ionipari, joka sisältää voimakkaimmat sähköstaattiset vuorovaikutukset, jotka voivat heijastua kvantitatiivisesti sen liukoisuusvakioarvoissa (KPS).
Useimmissa saostumisreaktioissa suola on kuitenkin liukoinen ja muut saostumat. Molemmat reaktiot - neutralointi ja saostuminen - voivat esiintyä samassa aineessa.
Esimerkkejä kaksinkertaisista korvausreaktioista
Esimerkki 1
HCl (AC) + NaOH (AC) => H2Tai (l) + NaCl (AC)
Millainen reaktio tämä on? Suolahapon reagoivat natriumhydroksidia tuottavan veden ja natriumkloridin kanssa seurauksena. Koska NaCl on hyvin liukoinen vesipitoiseen väliaineeseen ja että muodostettiin myös vesimolekyyli, esimerkin 1 reaktio on neutralointi.
Voi palvella sinua: bentseeni: historia, rakenne, ominaisuudet, johdannaiset, käytötEsimerkki 2
Leima3-A2(AC) + NA2S (ac) => cus (s) + 2nano3(AC)
Tässä reaktiossa niitä ei ole edes ion h+ Ei edes oh-, Eikä kemiallisen yhtälön oikealla puolella ole vesimolekyyli.
Kuparinitraatti (II) tai kupri -nitraatti, vaihtoa ioneilla natriumsulfidilla. Kuparisulfidi on liukenematon, saostava toisin kuin natriumnitraatti, suolaliukoinen.
Cu: n ratkaisu (ei3-A2 Se on sinertävää, kun taas na2S on kellertävä. Kun molemmat ovat sekoitettuja, värit katoavat ja cus saostuu, mikä on mustanpuoleisuus.
Esimerkki 3
CH3COOH (AC) + NaOH (AC) => ch3Poon (AC) + H2Tai (l)
Jälleen tämä on toinen neutralointireaktio. Etikkahappo reagoi natriumhydroksidin kanssa natriumasetaattisuolan ja vesimolekyylin muodostamiseksi.
Toisin kuin esimerkki 1, natriumasetaatti ei ole suola, joka on täysin ionisoitu, koska anion on hydrolysoitu:
CH3Kujertaa-(AC) + H2Tai (l) cho3COOH (AC) + OH-(AC)
Esimerkki 4
2Hi (AC) + Caco3(s) => h2Yhteistyö3(AC) + CAI2(AC)
Tässä reaktiossa - joka ei näytä olevan neutralointia - iarhydrinen happo reagoi kokonaan kalkkikiveyn hiilihappon ja kalsiumjodidin tuottamiseksi. Lisäksi lämpörahoitus (eksoterminen reaktio) hajottaa hiilihappoa hiilidioksidissa ja vedessä:
H2Yhteistyö3(AC) => CO2(g) + h2Tai (l)
Globaali reaktio säilyy:
2Hi (AC) + Caco3(s) => co2(g) + h2Tai (l) + cai2(AC)
Samoin kalsiumkarbonaatti, emäksinen suola, neutraloi iarchloriinihappoa.
Esimerkki 5
Agno3(ac) + nacl (ac) => agcl (s) + nano3(AC)
Voi palvella sinua: putrescina: rakenne, ominaisuudet, synteesi, käyttöHopea -nitraatti vaihtaa ionit natriumkloridilla, muodostaen siten liukenemattoman hopeakloridisuolan (valkoinen sakka) ja natriumnitraatti.
Esimerkki 6
2H3Poikki4(AC) + 3ca (OH)2(AC) => 6H2Tai (l) + ca3(PO4-A2(S)
Fosforihappo neutraloidaan kalsiumhydroksidilla, mikä muodostaa liukenemattoman kalsiumfosfaattuolan ja kuusi moolia vesimolekyylejä.
Tämä on esimerkki molempien tyyppien kaksinkertaisesta substituutioreaktiosta: liukenemattoman suolan hapon neutralointi ja saostuminen.
Esimerkki 7
K -k -2S (ac) + mgso4(ac) => k2Sw4(AC) + mgs (t)
Kaliumsulfidi reagoi magnesiumsulfaatin kanssa, keräämällä liuoksiin S -ioneihin2- ja mg2+ Liukenemattoman magnesiumsulfidin ja suola liukoisen kaliumsulfaatin muodostamiseksi.
Esimerkki 8
Naa2S (AC) + HCl (AC) → NaCl (AC) + H2S (g)
Natriumsulfidi neutraloi suolahappoa, tuottaen natriumkloridia ja rikkivetyä.
Tässä reaktiossa vettä ei muodostua (toisin kuin yleisimmät neutraloinnit), vaan ei -elektrolyyttinen molekyyli vety -rikkivety, jonka mätäisten munien haju on hyvin epämiellyttävää. H2S pakenee liuosta kaasumuodossa ja loput lajit pysyvät liuenneet.

