Avogadro -laki
- 3098
- 872
- Ronald Reilly
Mikä on Avogadron laki?
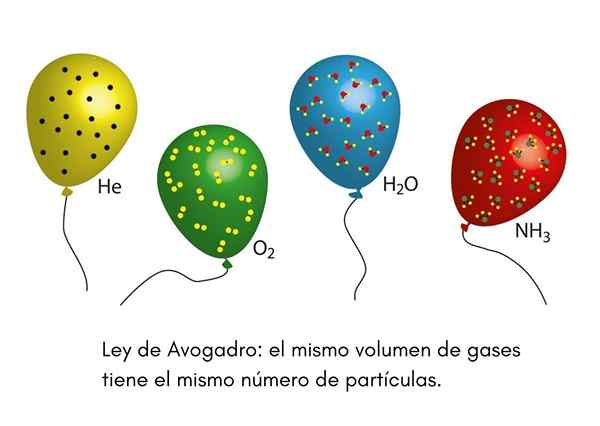
Se Avogadro -laki, Kutsutaan myös Avogadro -periaatteeksi, se on laki, joka koskee ihanteellisia kaasuja ja sen on kirjoitettu yhdeksästoista vuosisadan tutkija nimeltään Amadeo Avogadro. Tämä laki osoittaa, että kaksi yhtä suurta määrää erilaisia kaasuja, jotka ovat samoissa lämpötila- ja paineolosuhteissa, sisältää saman määrän kaasumaisia hiukkasia.
Tämä tarkoittaa, että jos meillä on kaksi ilmapalloa, yksi täynnä heliumia ja toinen happea, ja molemmilla ilmapalloilla on sama tilavuus, sama paine ja sama lämpötila, niin kaasumaisia helium -atomeja on sama määrä ensimmäisessä maapalloa, että happimolekyylit toisessa.
Avogadro Law Formula
Toinen tapa ilmoittaa Avogadron laki on sanoa, että jos jatkuvaa painetta ja lämpötilaa ylläpidetään, kaasun tilavuus on verrannollinen moolien lukumäärään. Tämä on edustettuna matemaattisella tavalla seuraavasti:
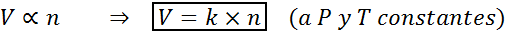
Tämä kaava voidaan järjestää uudelleen V/n = K, ts. Molan ja moolien lukumäärän välinen suhde pysyy vakiona aina, kun p ja t ovat vakioita.
Joten jos esittelemme tai poistamme tietyn määrän kaasua säiliöstä, joka pitää P- ja T -vakiona, tilavuus muuttuu ja alku- ja lopullinen tila liittyy seuraavan yhtälön avulla:

Olosuhteet, joissa Avogadron laki täytetään
Tämä laki koskee tarkalleen ihanteellisia kaasuja. Nämä ovat kaasuja, jotka muodostuvat tietyillä hiukkasilla (jotka eivät vie tilavuutta avaruudessa), jotka eivät ole vuorovaikutuksessa toistensa kanssa millään tavalla.
Se voi palvella sinua: Biodiesel: Historia, ominaisuudet, tyypit, edut, haitatKuten nimestä voi päätellä, tämän tyyppistä kaasua ei ole todellisuudessa, vaan mielikuvituksessa. Ne ovat yksinkertaistettu "idea" siitä, mikä uskomme olevan kaasua. On kuitenkin joitain olosuhteita, joissa todellinen kaasu, kuten ilma, käyttäytyy ihannetapauksessa: erittäin alhaisissa paineissa ja erittäin korkeissa lämpötiloissa.
Pienet paineet aiheuttavat kaasuhiukkasten käyttämän tilavuuden merkityksettömän verrattuna säiliön kokoon, kun taas korkeat lämpötilat saavat hiukkaset liikkumaan niin nopeasti, että niillä ei ole aikaa olla vuorovaikutuksessa, kun ne ylittävät keskenään.
Näissä olosuhteissa useimmat kaasut täyttävät Avogadron lain hyvällä tarkkuudella.
Avogadron lain merkitys
Yksi Avogadron lain tärkeimmistä panoksista oli, että se antoi osoittaa useamman kuin yhden atomin muodostuneiden peruskaasujen olemassaolon O O2 tai h2. Tämä vaikutti atomiteorian etenemiseen.
Lisäksi Avogadron laki täydentää Boylen, Charlesin ja Gay-Lussacin lakeja ja yhdistämällä sen näihin kolmeen lakiin, Avogadron laki sallii ihanteellisten kaasujen lain, joka on yksi kemian tärkeimmistä laeista.
Toisaalta Avogadron laki sallii myös suhteiden luomisen eri kaasujen molekyylipainojen välillä, koska se tarkoittaa, että samassa lämpötilassa ja paineessa mitattujen eri kaasujen yhtä suuret määrät ovat verrannollinen kunkin kaasun massaan massaa kunkin hiukkasen massa.
Voi palvella sinua: natriumnitraatti (nano3): rakenne, ominaisuudet, käytöt, riskitJoten yhden pahoittelunäytteillä kahdesta kaasusta, jotka käyttävät määriä yhtä suuret kuin sama lämpötila ja paine, sen moolimassan välinen suhde voidaan saada.
Esimerkkejä Avogadron laista jokapäiväisessä elämässä
Juhlapallot
Olemme koskaan nähneet pellon lastenjuhlissa täyttämässä heliumpalloja levittämään heidät lasten keskuudessa. Nämä ilmapallot ovat suunnilleen samassa lämpötilassa. Jos kaksi juhlapalloa täytetään samassa paineessa ja molemmat ovat samankokoisia, Avogadron laki varmistaa, että molemmilla ilmapalloilla on sama määrä helium -mooleja.
Toisaalta, jos yksi ilmapalloista on suurempi kuin toinen, sillä on suurempi tilavuus ja Avogadron lain mukaan siinä on suurempi määrä heliumpartikkeleita.
Auton renkaat
Riippumatta siitä, minkä kaasun ne täytetään, auton vastakkaisilla puolilla olevat renkaat ovat aina täynnä samaan lopulliseen paineeseen noin 32 psi.
Lisäksi varmistamme aina, että molemmat kuivet ovat samat, joten heillä on sama tilavuus. Siten Avogadro -periaatteen mukaan voimme sanoa, että molemmat renkaat sisältävät saman määrän kaasumaisia hiukkasia.
Ruisku täynnä ilmaa
Oletetaan, että meillä on avoin ruisku ja täynnä 50 cm3 ilmaa. Kuten on auki, ruiskun sisä- ja ulkopinta (ympäristö) ovat samassa lämpötilassa ja paineessa.
Oletetaan nyt, että painamme ruiskun männän ja siirrämme sitä, kunnes 10 cm luetaan3. Kun ruisku on paljastunut, ilma pakenee kärjen läpi männän liikkuessa, joten ruiskujen sisällä olevien ilmahiukkasten lukumäärä pienenee tilavuuden kanssa.
Voi palvella sinua: haihtuvuusKoska paine tai lämpötila ei muutu, Avogadro -lakia voidaan soveltaa liittämään lopullinen tilavuus ruiskun sisällä jäävien ilmahiukkasten määrään. Tämä suhde on:

Tämän yhtälön uudelleenjärjestelyssä saamme sen:
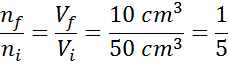
Tämä tulos tarkoittaa, että jos vähennämme ruiskun sisällä olevaa tilavuutta viidenteen, pitämällä P- ja T -vakiona, silloin prosessin lopussa olevien moolien tai hiukkasten lukumäärä on myös viides osa alun perin sitä.


