Rault -periaate ja kaavalaki, esimerkit, harjoitukset
- 2889
- 743
- Dr. Travis Reichert
Se Rauoltin laki Sitä käytetään selittämään liuoksessa olevaa höyrypaineen laskeutumista tai vähentämistä, koska ei -haihduttamattoman liuenneen aineen, kuten suolan tai orgaanisen yhdisteen, liukenemisen vuoksi.
Tätä lakia käytetään myös analysoimaan ja kuvaamaan haihtuvien liuottimien koostumusta kaasufaasissa, joka sijaitsee tilassa liuoksessa, joka esittelee niistä. Laki kantaa hänen nimensä sen luojan François-Marie Rauoltin (1830-1901) kunniaksi.
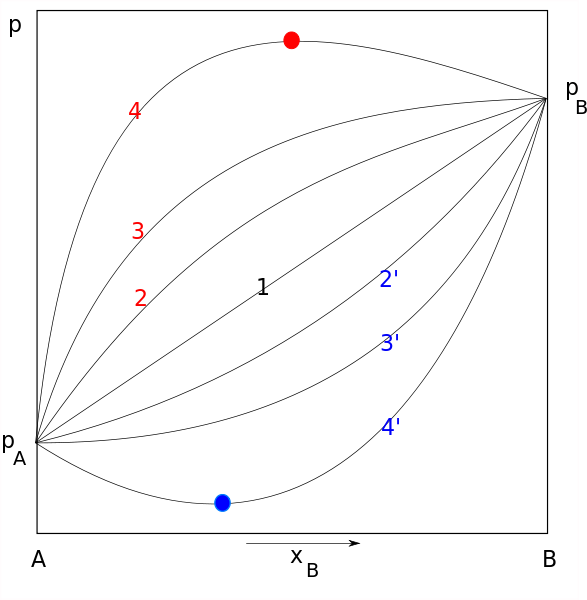
 Raaultin lakikaaviot. Rivi 1 edustaa ihanteellista käyttäytymistä, kun taas punainen ja sininen vastaavat vastaavasti positiivisia ja negatiivisia poikkeamia. Lähde: Joanna Kośmider / Public Domain
Raaultin lakikaaviot. Rivi 1 edustaa ihanteellista käyttäytymistä, kun taas punainen ja sininen vastaavat vastaavasti positiivisia ja negatiivisia poikkeamia. Lähde: Joanna Kośmider / Public Domain Rauoltin lakia sovelletaan ihanteellisiin liuoksiin, jotka vastaavat joitain ominaisuuksia, mukaan lukien seuraavat: Molekyylien väliset voimat yhtä suuret molekyylien (koheesiovoimat) välillä on oltava yhtä suuri kuin molekyylien väliset voimat eri tai erilaisten molekyylien välillä (liimat) (liimat)).
Monet ratkaisut eivät ole ihanteellisia, mikä selittää Rauoltin lain poikkeamat, joita havaitaan joissain haihtuvien liuottimien seoksissa. Esimerkiksi kloroform -seos (CH3Cl) ja asetoni (valitse3Kokki3), on negatiivinen poikkeama Raoulin laista.
 François-Marie RAAULT
François-Marie RAAULT Kaasufaasin höyrynpaine tällaisissa tapauksissa on pienempi kuin lailla ennustettu, selitettävä muodostumalla vety sillat seoksen komponenttien välillä.
[TOC]
Periaate ja kaava
Rauoltin laki osoittaa, että kaasuseoksen haihtuva komponentti tai liuotin liuoksen yläpuolella oleva osittainen höyrynpaine liittyy puhtaan haihtuvan komponentin tai liuottimen ja niiden vastaavien molaaristen fraktioiden aiheuttamaan höyrypaineeseen ja niiden vastaaviin molaarisiin fraktioihin, jotka.
Voi palvella sinua: nepelometriaSeuraava yhtälö on yhteenveto yllä:
PSV = PSVº · xSV
Missä pSV Se on haihtuvan liuottimen osittainen paine sooda -seoksessa, PSVº puhtaan haihtuvan liuottimen paine ja xSV Molaarinen fraktio haihtuvan liuottimen liuoksessa.
Haihtuvien liuottimien seos
Jos liuoksessa on kahden haihtuvan liuottimen (a ja b) seos, voit laskea höyrypaineen, jonka ne ovat peräisin kaasufaasista, liuoksen yläpuolella. Tämä on kaasujen A ja B osittaisten paineiden summa:
P-Lla = X-Lla · P-Llaº
PB - = XB - · PB -º
Joten A- ja B -paineiden lisääminen saamme kokonaisen P -paineen:
P = x-Lla · P-Llaº +xB - · PB -º
Missä p on soodaseoksen höyrypaine liuoksen päällä, x-Lla ja xB - haihtuvien liuottimien A ja B molaariset fraktiot seoksessa ja p-Llaº ja PB -º Puhtaiden haihtuvien liuottimien a ja b höyrypaineet.
Vähentynyt paine kaasufaasissa johtuen haihduttamattoman liuenneen aineen läsnäolosta
Haihtuva liuottimen osittainen paine kaasufaasissa annetaan lausekkeella:
P = p-Llaº · x-Lla
Liuoksen B -aineen läsnä ollessa liuoksessa B: n molaarinen fraktio ilmaistaan seuraavasti:
XB - = 1 -x-Lla
Sitten, yksinkertaisen matemaattisen hoidon avulla, ilmaisu saavutetaan:
ΔP = P-Llaº · xB - (1)
Missä ΔP on liuottimen osittaisen paineen lasku kaasufaasissa.
Matemaattinen ekspressio (1) osoittaa liuottimen höyrypaineen laskun ei -haihduttamattoman B liuenneen aineen läsnäolosta johtuen. Liuotinhöyrynpaineen lasku on selitetty johtuen liuenneen B -molekyylien sijainnista liuoksen pinnalla.
Se voi palvella sinua: Karbonyyliryhmä: Ominaisuudet, ominaisuudet, nimikkeistö, reaktiivisuusLiuenneen B -molekyylien läsnäolo aiheuttaisi liuottimen A molekyylien pitoisuuden vähentymisen liuoksen pinnalla rajoittaen sen haihtumista; Ja siten selittäen, höyrynpaineen väheneminen kaasufaasissa.
Esimerkit
RAAULT: n laki laskee liuoksen haihtuvan komponentin, kuten etanolin, bentseenin, tolueenin, etaanin, propaanin, jne., avaruudessa liuoksessa.
Sitä voidaan käyttää avaruudessa syntyneen höyrypaineen laskemiseen haihtuvien nesteiden, joko bentseenin ja tolueenin, etaanin ja propaanin, asetonin ja etanolin jne. Seoksen seurauksena, seurauksena.
Lisäksi tällä laki voi määrittää, mikä on höyrynpaineen väheneminen, jos esimerkiksi se liukenee sakkaroosia veteen, olematta haihduttamaton liuenneaine.
Ratkaisut
Harjoitus 1
Laske valmistetun liuoksen höyrypaine liuottamalla 60 g natriumkloridia (NaCl) 400 g vettä (H2JOMPIKUMPI). Vesihöyryn paine (PH2Oº) 37 ºC on 47,1 mmHg. Molekyylipaino H2O = 18 g/mol ja molekyylipainoinen NaCl = 58,5 g/mol.
Laskemme ensin veden ja natriumkloridin moolit niiden molaaristen fraktioiden määrittämiseksi:
H: n moolit2O = h: n grammat2O / pm h2JOMPIKUMPI
= 400 g / (18 g / mol)
= 22,22 moolia
NaCl = g: n moolit NaCl / pm NaCl
= 60 g / (58,5 g / mol)
= 1,03 moolia
NaCl on elektrolyyttinen yhdiste, joka dissosioituu NA: ssa+ + Cl-. Siksi 1,03 moolia NaCl: n dissosioituneita 1,03 moolia NA: ta+ ja 1,03 moolia CL: tä-.
Se voi palvella sinua: Maillard -reaktioMeillä on ilmaus:
Pv = XH2O · PH2Oº
Siksi meiltä puuttuu veden molaarinen osa:
XH2O = H: n moolit2O / (H: n moolit2O +moolit NA: ta+ + Cl: n moolit--A
= 22,2 moolia / 22,22 moolia +1,03 moolia +1,03 moolia
= 0,896
Ja laskemme pv-
Pv = 47,1 mmHg · 0.896
Pv = 42,20 mmHg
On natriumkloridin läsnäolon vuoksi höyrynpaineen väheneminen:
ΔPv = 47,1 mmHg - 42,20 mmHg
= 4,9 mmHg
Harjoitus 2
Lämpötilassa -100 ºC etaani (valitse3CH3) ja propaani (CHO3CH2CH3) Ne ovat nesteitä. Tässä lämpötilassa puhtaan etaanin höyrynpaine (PEtanoº) on 394 mmHg, kun taas puhtaan propaanin höyrynpaine (Ppropaaniº) on 22 mmHg. Mikä on höyrynpaine liuokseen, joka sisältää molempien yhdisteiden ekvimolaarisia määriä?
Ongelmalähestymistapa osoittaa, että liuos sisältää yhdisteiden ekvimolaarisia määriä. Tämä tarkoittaa, että yhdisteen ja propaaneiden molaarinen fraktio on välttämättä yhtä suuri kuin 0,5.
Ratkaisu tulee jälleen lausekkeella:
Pv = PEtano + Ppropaani
Laskemme sekä etaanin että propaanin osittaiset paineet:
PEtano = PEtanoº · xEtano
= 394 mmHg · 0,5
= 197 mmHg
Ppropaani = Ppropaaniº · xpropaani
= 22 mmHg · 0,5
= 11 mmHg
Ja niin laskemme lopulta p: nv-
Pv = PEtano + Ppropaani
= 197 mmHg +11 mmHg
= 208 mmHg
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen
- Wikipedia. (2020). Raultin laki. Haettu: vuonna.Wikipedia.org
- Helmestine, Anne Marie, PH.D -d. (11. helmikuuta 2020). Raultin lain määritelmä kemiassa. Toipunut: Admingco.com
- Encyclopædia britannica. (2020). Raultin laki. Toipunut: Britannica.com
- Clark j., Ly i., & Khan S. (18. toukokuuta 2020). Raultin laki. Kemian librettexts. Palautettu: Chem.Librettexts.org
- « Kulmaisen vauhdin määrä, säilyttäminen, esimerkit, harjoitukset
- Läpinäkymättömät objektit käsite, ominaisuudet ja esimerkit »

