Smozyme -ominaisuudet, rakenne, toiminnot
- 2645
- 760
- Arthur Terry II
Se Smotsyymit Ne ovat hydrolyyttisiä entsyymejä, jotka on levinnyt laajasti luonnossa, jotka kykenevät hydrolysoimaan peptidoglykaanin glukosidisia sidoksia bakteerien seinämässä. Ne ovat läsnä kasveissa ja eläimissä ja ne toimivat puolustusmekanismina bakteeri -infektioita vastaan.
Näiden entsyymien löytäminen juontaa juurensa vuoteen 1922, kun Alexander Fleming tajusi, että oli proteiini, jolla oli Lisar -bakteerien katalyyttinen kyky joissain kudoksissa ja ihmisen erityksissä.
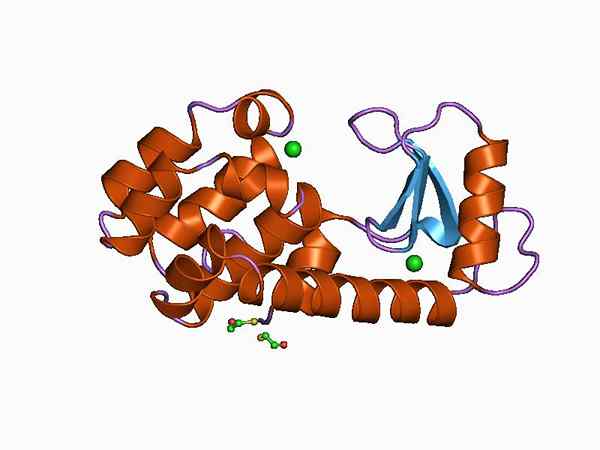
 Graafinen esitys sileyden rakenteesta (lähde: Jawahar Swaminathan ja MSD: n henkilökunta Euroopan bioinformatiikan instituutissa [julkinen alue] Wikimedia Commonsin kautta)
Graafinen esitys sileyden rakenteesta (lähde: Jawahar Swaminathan ja MSD: n henkilökunta Euroopan bioinformatiikan instituutissa [julkinen alue] Wikimedia Commonsin kautta) Helppo hankkimisensa ja pienen koon ansiosta Lysozy. Sitä käytetään tällä hetkellä kemian, entsyymin, kristallografian ja proteiinimolekyylibiologian mallijärjestelmänä.
Smotsyymi on "bakterioliittinen" entsyymi, joka on erikoistunut β -1,4 -glukosidisidoksen gram -positiivisten bakteerien hydrolyysiin.
Sillä on erilaisia toimintoja, sekä ruuansulatuksessa että immunologisia, kaikissa organismeissa, joissa se ilmaistaan ja käytetään bioteknologisena resurssina useita tarkoituksia varten.
[TOC]
Ominaisuudet
Planeetalla elävien organismien pääryhmät ilmaisevat sileyden, mutta ne ovat erityisen runsaasti eläimissä ja juuri niistä on puhdistettu ja tutkittu enemmän.
Ihmisillä lystsyymi on korkeissa pitoisuuksissa eri nesteissä ja kudoksissa, kuten maksassa, rustossa, sylkeessä, limassa ja kyyneleissä. Sen ilmentävät hematopoieettiset solut ja sitä esiintyy myös granulosyyteissä, monosyyteissä ja makrofageissa sekä muissa luuytimen esiastesoluissa.
Voi palvella sinua: karkea endoplasminen retikulumKasvien alkuperän smotsyymit hydrolysoivat substraatit, jotka ovat samanlaisia kuin muut kitinaasiksi kutsuttuja läheisesti liittyviä entsyymejä, tästä syystä ne voivat myös hydrolysoitua sidoksia kitiinissä, vaikkakin vähemmän tehokkuudella.
Eläinten sileystyypit ja niiden ominaisuudet
Ainakin kolme tyyppistä sileyttä on kuvattu eläinvaltakunnassa:
-Sileä c ("c"conlisäinen "tai"cHicken ", Mitä kana tarkoittaa englanniksi)
-Smozyme g ("g" of "gOose”, Mikä tarkoittaa hanhi englanniksi) ja
-Sileä tyyppi I ("i" of "Yllyttäänverteerit ”)
Kolme smoothie -luokkaa eroavat toisistaan suhteessa niiden aminohapposekvensseihin, niiden biokemiallisiin ominaisuuksiin ja entsymaattisiin ominaisuuksiin.
Tyyppi C
Näitä sileyyttä pidetään tämän perheen ”malli” entsyymeinä, koska ne ovat toimineet mallina rakenteille ja toimintotutkimuksille. Ne tunnetaan nimellä "c" englanninkielistä "Kiva"Koska ne eristettiin ensin kananmunista.
Tässä luokassa on useimpien selkärankaisten tuottama sileys, etenkin lintujen ja nisäkkäiden kanssa. Se sisältää myös joissakin niveljalkaisissa entsyymejä, kuten Lepidoptera, Diptera, jotkut arachnidit ja äyriäiset.
Ne ovat pieniä entsyymejä, koska niillä on molekyylipaino, joka ei ylitä 15 kDa. Ne ovat emäksisiä proteiineja, joilla on korkeat isoelektriset pisteet.
ALENEEN Tyyppi G
Tämän tyypin ensimmäinen sileys tunnistettiin munan kirkkaana.
Joissakin tapauksissa GY -tyypin tasot ovat runsaampia kuin tyypin C tasot tiettyjen lintujen munavalkuaisissa, kun taas päinvastoin tapahtuu, tyypin C sileät CS: t ovat runsaampia.
Voi palvella sinua: LenticelaNäitä sileyttä esiintyy myös simpukka nilviäisissä ja eräissä tunikoissa. Ne ovat hiukan suurempia proteiineja kuin tyypin C, mutta niiden molekyylipaino ei yleensä ylitä 25 kDa.
Tyyppi I
Nämä sileyydet ovat läsnä pääasiassa selkärangattomien eläimissä. Sen läsnäolo on määritetty anélidosissa, eekinodermeissa, äyriäisissä, hyönteissä, nilviäisissä ja nematodeissa, ja se ei ole nisäkkäissä ja muissa selkärankaisissa.
Heillä on enemmän happamia isoelektrisiä pisteitä kuin tyypin C ja tyypin G proteiinit.
Rakenne
Edellisessä osassa kuvattuilla kolmella eläinentsyymityypeillä on melko samanlaiset kolme dimensionaalista rakennetta.
Ihmisten sileys on sileä tyyppi C ja se oli ensimmäinen näistä entsyymeistä, joita tutkitaan ja rakenteellisesti karakterisoidaan. Se on pieni proteiini, jossa on 130 aminohappojätettä, ja sitä koodataan geenillä, joka sijaitsee kromosomissa 12, jossa on 4 eksonia ja 3 intronia.
Sen rakenne on jaettu kahteen verkkotunnukseen: toinen tunnetaan nimellä domeeni α Ja toinen kuin β -domeeni. Α -domeeni koostuu neljästä alfa -salista ja antiparalleLa P -levyn ja suuren silmukan muodostama β -domeeni.
Entsyymin katalyyttinen kohta on rakoissa, jotka muodostetaan molempien domeenien välillä ja substraatin kanssa risteyksessä on glutamiinihapon ja asparagiinihapon jätettä. Lisäksi siinä on ainakin kuusi ”subitios”, jotka tunnetaan nimellä A, B, C, D, E ja F, jotka kykenevät yhdistämään kuusi peräkkäistä sokerin tuhlausta.
Funktiot
Sileydella ei ole vain fysiologisia toimintoja suojaamisessa ja taisteluissa sitä ilmaisevien organismien bakteeri -infektioilta.
Voi palvella sinua: epiteelisolut oksaitaNykyisessä teollisuudessa se tunnustetaan voimakkaaseen bakteerisideksi ja sitä käytetään elintarvikkeiden ja lääkkeiden säilyttämiseen.
Nämä entsyymit katalysoivan reaktion ansiosta ne voivat toimia erilaisiin bakteeripopulaatioihin ja muuttaa niiden seinien stabiilisuutta, joka myöhemmin muuttuu solujen hajoamiseksi.
Yhdessä muiden samanlaisten entsyymien kanssa sileys voi toimia sekä gram -positiivisiin bakteereihin että gram -negatiivisiin bakteereihin, joten niitä voidaan pitää erityyppisten organismien antibakteerisen "immuuni" -järjestelmän osina.
Nisäkkäiden veressä olevissa valkosoluissa näillä entsyymeillä on tärkeitä toimintoja tunkeutuvien mikro -organismien hajoamisessa, joten ne ovat välttämättömiä ihmisten ja muiden nisäkkäiden immuunijärjestelmälle.
Kasvien smotsyymit täyttävät olennaisesti samat toiminnot kuin eläimissä, jotka ilmaisevat niitä, koska ne ovat ensimmäisenä puolustuslinjana bakteerien taudinaiheuttajia vastaan.
Viitteet
- Callewaert, L., & Michels, W. (2010). Lysotsyymejä eläinvaltakunnassa. J -. Biosci., 35(1), 127-160.
- Merlini, G., & Bellotti, V. (2005). Lysotsyymi: Paradigmaattinen molekyyli proteiinirakenteen, toiminnan ja vääristymisen tutkimiseksi. Klinikan kemiallinen teko, 357, 168-172.
- Katso. (1977). Lysozyme: Lyhyt katsaus. Jatko -lääketieteellinen päiväkirja, 53, 257-259.
- Sahoo, n. R -., Kumar, P., Bhusan, b., Bhattacharya, t. K -k -., Päivä, s., & Sahoo, M. (2012). Lysotsyymi karjan kielellä: Opas valintaverkkoon. Eläintieteiden lehti, 2(4), 347-360.
- Wohlkönig, a., Huet, J., Looze, ja., & Wintjens, R. (2010). Lysotsyymin superperheen rakennesuhteet: merkittäviä todisteita glykosidihydrolaasin allekirjoitusmotiivien suhteen. Plos yksi, 5(11), 1-10.
- « Oyamel -ominaisuudet, elinympäristö ja jakelu, käyttää
- Ydinhuokosominaisuudet, toiminnot, komponentit »

