Myoglobiini

- 5132
- 965
- Sheldon Kuhn
 Myoglobiinirakenne
Myoglobiinirakenne Mikä on myoglobiini?
Se Myoglobiini Se on solunsisäinen globaali proteiini, jota löytyy luurankojen ja sydämen lihassolujen sytosolista. Sen perustavanlaatuinen tehtävä on muodostaa happireservi ja suosia solunsisäistä happikuljetusta.
John Kendrew ja Max Perutz saivat Nobelin kemian palkinnon vuonna 1962 tutkimuksistaan globaalista proteiineja koskevista tutkimuksista. Nämä kirjoittajat selventävät vastaavasti myoglobiinin ja hemoglobiinin kolmen dimensionaalista rakennetta. Historiallisesti myoglobiini oli yksi ensimmäisistä proteiineista, joista kolmiulotteinen rakenne määritettiin.
Globular -proteiinit ovat kompakteja molekyylejä, joilla on pallomainen muoto; Ne ovat liukoisia sytosolissa tai solukalvojen lipidiosassa. Ne ovat vastuussa tärkeimmistä biologisista vaikutuksista, toisin kuin kuituproteiinit, joiden päätoiminnot ovat rakenteellisia.
Myoglobiini antaa tuoretta lihaa punaisen. Tämä tapahtuu, kun myoglobiini hapetetaan oksimioglobiiniksi ja sen säveltävä rauta on raudassa: mb-fe2+o2.
Kun liha altistuu ympäristölle, rauta, epävakaa, hapettu ja muuttuu rauta- ja näissä olosuhteissa väri muuttuu ruskeiksi sävyiksi metamioglobiinin muodostumiselle (MB-Fe3 + + O2 ●-).
Normaalisti veriglobiinin tasot ovat hyvin pieniä, ne ovat mikrogrammien järjestyksessä litralta (μg/l). Nämä tasot nousevat, kun lihaksen tuhoaminen tapahtuu kuten luurankojen lihaksen rabdomyolyysi tai sydämen infarkti kudoksen tuhoamisella ja joissain myopatioissa.
Sen läsnäolo virtsassa havaitaan tietyissä olosuhteissa, joissa kudosvaurio on erittäin tärkeä. Sen varhainen diagnostinen arvo sydämen infarktille on kiistanalainen.
Voi palvella sinua: soluydinMyoglobiinirakenne
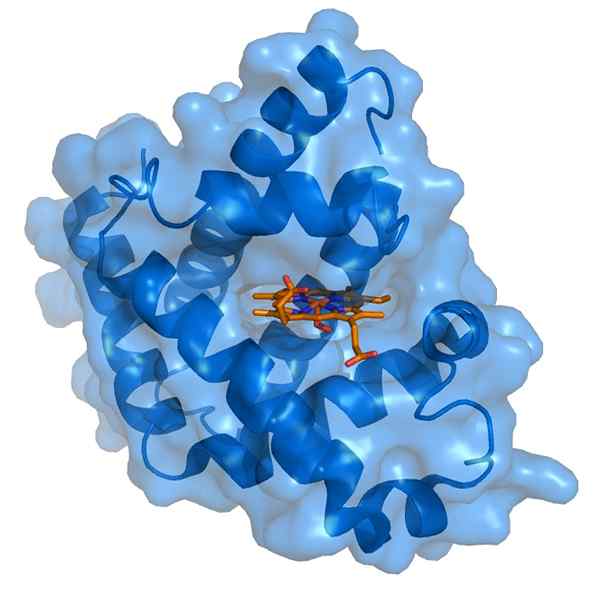 Myoglobiini ja sen Hemo-proteesiryhmä (lähde: Thomas Spletttsser/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0) Wikimedia Commonsin kautta)
Myoglobiini ja sen Hemo-proteesiryhmä (lähde: Thomas Spletttsser/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0) Wikimedia Commonsin kautta) Myoglobiinin molekyylipaino on melkein 18 kDa, mukaan lukien Hemo -ryhmä. Se koostuu neljästä kierteisestä segmentistä, jotka ovat yhdistäneet "äkilliset käännökset". Nämä myoglobiinin potkurit ovat tiiviisti pakattuja ja ylläpitävät rakenteellista eheyttään myös silloin, kun Hemo -ryhmä poistetaan.
Globaalien proteiinien, samoin kuin kaikkien soluproteiinien rakenne on hierarkkinen, joten myös myoglobiinin rakenne on. Ensimmäinen taso on ensisijainen rakenne, joka muodostuu amino -happojen lineaarisesta sekvenssistä ja myoglobiini koostuu 153 aminohappiketjusta.
Myoglobiinin toissijainen rakenne koostuu alfa -potkurin muodostumisesta. Myoglobiini sisältää 8 alfapotkuria, jotka on muodostettu toistuvilla polypeptidiosalla, jotka sitovat lyhyillä aperiadisilla hallintasegmenteillä.
Tertiäärinen rakenne koostuu kolmen ulottuvuuden muodostumisesta biologisen aktiivisuuden kanssa. Tämän rakenteen tärkeimmät ominaisuudet ovat taittaminen. Kvaternäärinen rakenne viittaa kahden tai useamman erillisen ja yhtenäisen polypeptidiketran kokoonpanoon ei -kovalenttisten linkkien tai vuorovaikutusten kautta.
Myoglobiinilla on erittäin kompakti rakenne, ja hydrofobinen jäte on suunnattu kohti sisä- ja hydrofiilisiä tai polaarisia tähteitä, jotka on suunnattu ulospäin. Sisäinen apolaarinen jäte muodostetaan leusiini, valiini, menetelmä ja fenyylialaniini. Ainoa sisäinen napajäte on kaksi histidiiniä, joilla on toiminnot aktiivisessa keskuksessa.
Hemo -proteesiryhmä sijaitsee polyloglobiinipolypeptidiketjun apolaarisen sisäosan rakoissa. Tämä ryhmä sisältää rautaa rautaraudan muodossa, joka sitoutuu happea muodostamaan oksimioglobiinia.
Voi palvella sinua: GLUT4: Ominaisuudet, rakenne, toiminnotMyoglobiinitoiminto
Myoglobiinin tehtävänä on yhdistää happi sen rakenteen hemo -ryhmään ja muodostaa happireservi lihaksen toimintaan. Sikäli kuin happi on loukussa myoglobiinin rakenteessa lihassolun sytoplasmassa, sen solunsisäinen paine, joka määritetään vapaasti happea, pysyy matalana.
Matala solunsisäinen happipaine ylläpitää hapenpoistoaukon kaltevuutta soluun. Tämä suosii hapen kulkua verenkierrosta torrentista lihassoluun. Kun myoglobiini kyllästyy solunsisäisen hapen kasvaa, mikä vähenee asteittain gradienttia ja vähentää siten siirtoa.
Myoglobiiniin liittyvä happea sitova käyrä on hyperbolinen. Käyrän alkuperäisissä osissa pienet muutokset osittaisessa happipaineessa tuottavat suuria muutoksia myoglobiinin kyllästymisessä hapen kanssa.
Sitten siinä määrin, että osittainen happipaine lisää kylläisyyttä, kasvaa edelleen, mutta hitaammin, toisin sanoen osittaisen happipaineen huomattavasti suurempi lisääntyminen myoglobiinin kyllästymisen lisäämiseksi, ja käyrä on asteittain tasoittuva.
On muuttuja, joka mittaa P50 -nimisen käyrän affiniteettia, tämä edustaa hapen osittaista painetta, joka on tarpeen liuoksen sisältämän myoglobiinin kyllästymiseksi 50%: lla. Joten jos P50 kasvaa, sanotaan, että myoglobiinilla on vähemmän affiniteettia ja jos P50 vähentää, sanotaan, että myoglobiinilla on suurempi affiniteetti happeaan.
Voi palvella sinua: Preeritroblast: Ominaisuudet, morfologia, säätely, värjäysKun tutkitaan happea sitovia käyriä myoglobiinin ja hemoglobiinin kanssa, havaitaan, että missä tahansa osittaisessa happipaineessa myoglobiini on kyllästetty eikä hemoglobiini, mikä osoittaa, että myoglobiinilla on suurempi affiniteetti happea kuin happea kuin hemoglobiini.
Lihaskuidut ja myoglobiini
Luuston lihaksilla on koostumuksessaan erityyppisiä lihaskuituja, jotkut hitaat kontraktiopuhelut ja muut nopea supistuminen. Nopeat supistumiskuidut ovat rakenteellisesti ja metabolisesti sopeutuneet sopimukseen nopeasti ja voimakkaasti ja anaerobisella tavalla.
Hitaat supistumiskuidut on sopeutettu alhaisen nopeuden suhteen, mutta pitkittyneempiä supistuksia, jotka ovat tyypillisiä aerobisten vastusharjoittelujen suhteen. Yksi näiden kuitujen rakenteellisista eroista on myoglobiinin pitoisuus, joka antaa heille nimen valkoisten ja punaisten kuitujen nimen.
Punaisten kuiduilla on korkea myoglobiinipito.
Normaalit arvot
Miesten normaalit veriarvot ovat 19 - 92 µg/l ja naisilla 12 - 76 µg/l, eri laboratorioiden arvoissa on eroja.
Nämä arvot kasvavat, kun lihasten tuhoaminen tapahtuu kuten luurankojen lihaksen rabdomyolyysissä, laajoissa palovammoissa, sähköisissä iskuissa tai laajassa lihasnekroosissa valtimoiden tukkeuman vuoksi, sydäninfarktissa ja joissakin myopatioissa.
Näissä olosuhteissa myoglobiini ilmestyy virtsaan ja antaa sille ominaisen värin.

