Broglie -atomimalli

- 1057
- 74
- Edgar VonRueden
Hän Broglie -atomimalli Ranskalainen fyysikko Louis Broglie ehdotti sitä vuonna 1924. Broglie sanoi tohtorin tutkielmassaan elektronien aalto-hiukkasten kaksinaisuuden, luomalla aaltoilevan mekaniikan perusta. Broglie julkaisi tärkeät teoreettiset havainnot aalto-corpusculus-luonteesta.
Myöhemmin Broglie -lausunnot osoittivat kokeellisesti tutkijat Clinton Davisson ja Lester Germer, vuonna 1927. Broglie -elektronien aaltoteoria perustuu Einsteinin ehdotukseen valon aaltoilevista ominaisuuksista lyhyillä aallonpituuksilla.
 Louis Broglie
Louis Broglie Broglie ilmoitti mahdollisuudesta, että aineella oli samanlainen kuin valon käyttäytyminen, ja ehdotti samanlaisia ominaisuuksia subatomisissa hiukkasissa, kuten elektroneissa.
Sähkö- ja kiertoratakuormat rajoittavat elektronien kuvaaman aallon amplitudia, pituutta ja taajuutta. Broglie selitti elektronien liikkumisen atomi -ytimen ympärillä.
[TOC]
Broglie -atomismallin ominaisuudet
Ehdotuksensa kehittämiseksi Broglie aloitti periaatteesta, jonka mukaan elektronit olivat kaksinkertainen luonne aallon ja hiukkasten välillä, samanlainen kuin valon.
Tässä mielessä Broglie teki samanlaisen kahden ilmiön välillä ja perustuen Einsteinin kehittämiin yhtälöihin valon aaltoilevan luonteen tutkimiseksi, sanoi seuraava:
- Fotonin kokonaisenergia ja siten elektronin kokonaisenergia johtuu aaltotaajuuden ja lankkuvakion tuotteesta (6 62606957 (29) × 10 -3. 4 Jules x sekuntia), kuten seuraavassa lausekkeessa yksityiskohtaisesti:

Tässä ilmaisussa:
E = elektronienergia.
H = lankkuvakio.
F = aaltotaajuus.
- Fotonin ja siksi elektronin lineaarinen momentti on käänteisesti verrannollinen aallon pituuteen, ja molemmat suuruudet liittyvät lankkuvakion läpi:
Voi palvella sinua: käänteinen osmoosi: miten se toimii, mihin se on, esimerkkejä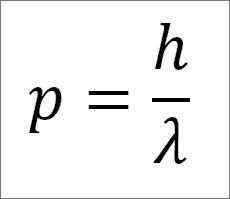
Tässä ilmaisussa:
P = elektronin lineaarinen momentti.
H = lankkuvakio.
λ = aallonpituus.
- Lineaarinen hetki on hiukkasten massan tuote, joka johtuu nopeudesta, joka mainitulla hiukkasella on sen siirtymän aikana.
Jos edellinen matemaattinen lauseke rakenneuudistetaan uudelleen aallonpituudesta, seuraava on:
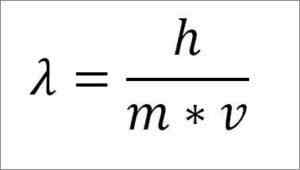
Siinä ilmaisussa:
λ = aallonpituus.
H = lankkuvakio.
m = elektronimassa.
V = elektronien nopeus.
Koska H, lankkuvakio, on pieni arvo, myös aallonpituus λ on. Tämän seurauksena on mahdollista todeta, että elektronin aaltoominaisuudet esitetään vain atomi- ja subatomisilla tasoilla.
- Broglie perustuu myös Bohr -atomimallin postulaateihin. Viimeksi mainitun mukaan elektronien kiertoradat ovat rajoitetut ja voivat olla vain kokonaislukujen kerrannaisia. Niin:
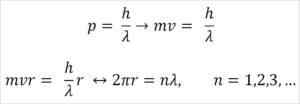
Missä:
λ = aallonpituus.
H = lankkuvakio.
m = elektronimassa.
V = elektronien nopeus.
R = kiertoradan säde.
n = kokonaisluku.
Bohrin atomimallin mukaan, johon Broglie hyväksyi pohjana, jos elektronit käyttäytyvät paikallaan olevina aaltoina, ainoat sallitut kiertoradat ovat ne, joiden säde on yhtä suuri kuin koko aallonpituus λ.
Siksi kaikki kiertoradat eivät ole elektronin tarvittavien parametrien mukaisia näiden läpi näiden läpi. Siksi elektronit voivat liikkua vain tietyillä kiertoradalla.
Broglien elektronien aaltoteoria perusti Bohrin atomimallin menestyksen selittämään vetyatomin ainutlaatuista elektronikäyttäytymistä.
Voi palvella sinua: kuiva akkuSamoin hän antoi myös valoja, miksi tämä malli ei sopeutunut monimutkaisempiin järjestelmiin, ts. Atomit, joissa on useampi kuin yksi elektroni.
Davisson ja Germer -kokeilu
Broglie -atomimallin kokeellinen tarkistus tapahtui 3 vuotta myöhemmin sen julkaisemisesta, vuonna 1927.
Yhdysvaltain näkyvät fyysikot Clinton J. Davisson ja Lester Germer vahvistivat kokeellisesti aaltoilevan mekaniikan teorian.
Davisson ja Germer suorittivat elektronisäteen dispersiotestit nikkelikristallin läpi ja havaitsivat diffraktion ilmiön metallisen ympäristön läpi.
Suoritettu koostumus koostui seuraavan menettelyn suorittamisesta:
- Ensinnäkin asetettiin elektronisäteellä varustettu kokoonpano, jolla oli tunnettu alkuenergia.
- Asennettiin jännitelähde elektroniliikkeen nopeuttamiseksi, jotka yllyttävät potentiaalieroa.
- Elektronisäteen virtaus metallilasiin kohdistettiin; Tässä tapauksessa nikkeli.
- Nikkelilasiin osuvien elektronien lukumäärä mitattiin.
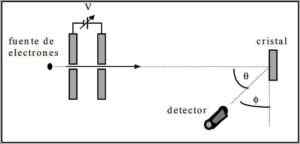
Kokeilun lopussa Davisson ja Germer havaitsivat, että elektronit leviävät eri suuntiin.
Kun toistat koetta käyttämällä metallikiteitä, joilla on erilaisia suuntauksia, tutkijat havaitsivat seuraavat:
- Elektronisäteen dispersio metallilasin läpi oli verrattavissa valohäiriöiden häiriöiden ja diffraktioiden ilmiöön.
- Elektronien heijastus iskusalasilla kuvasi suuntausta, jonka teoreettisesti tulisi kuvata Broglie Electron Wave -teorian mukaan.
Lyhyesti sanottuna Davisson ja Germer -koe kokeellisesti osoittivat elektronien kaksoisaalto-hiukkasen luonteen.
Voi palvella sinua: Polar Covalent Link: Ominaisuudet ja esimerkitRajoitukset
Broglien atomimalli ei ennusta elektronin tarkkaa sijaintia kiertoradalla, jossa se liikkuu.
Tässä mallissa elektronit pidetään aaltoina, jotka mobilisoidaan koko kiertoradalla ilman tiettyä sijaintia, joka esittelee sähköisen kiertoradan käsitteen.

Lisäksi Broglien atomimalli, joka on analoginen Schrödinger -mallin kanssa, ei harkitse elektronien pyörimistä samalla akselilla (pyöriä-A.
Huomauttamalla elektronien luontainen kulmavirta, näiden subatomisten hiukkasten alueelliset variaatiot jätetään sivuun.
Samassa ideajärjestyksessä tässä malli ei myöskään ota huomioon nopean elektronien käyttäytymisen muutoksia relativististen vaikutusten seurauksena.
Kiinnostavia artikkeleita
Schrödinger Atomic -malli.
Chadwick Atomic -malli.
Heisenberg Atomic -malli.
Perrin Atomic -malli.
Thomson Atomic -malli.
Dalton Atomic -malli.
Dirac Jordan Atomic -malli.
Democritus Atomic -malli.
Leucpo -atomimalli.
Bohr -atomimalli.
Nykyinen atomimalli.
Viitteet
- Bohrin kvanttiteoria ja de Broglie -aallot (S.F.-A. Toipunut: Ne.Fyysinen.Kyushu-U.Ac.J -
- Louis de Broglie - Biografinen (1929). © Nobel -säätiö. Palautettu: Nobelprize.org
- Louis-Victor de Broglie (S.F.-A. Haettu: Chemed.Kemia.Purduke.Edu
- Lovett, b. (1998). Louis de Broglie. Encyclopædia Britannica, Inc. Toipunut: Britannica.com
- De Broglie Atomic -malli. Etäopetuksen kansallinen yliopisto. Espanja. Palautettu: OCW.Innovaatio.Ulottuva.On
- Louis de Broglie.F.-A. Toipunut: Hiru.Eus
- Von Pamel tai., Ja Marchisio, S. (S.F.-A. Kvanttimekaniikka. Rosarion kansallinen yliopisto. Toipunut: Fceia.a r.Edu.AR

