Schrödinger Atomic -malli

- 945
- 24
- Dr. Travis Reichert
Mikä on Schrödingerin atomimalli?
Hän Schrödinger Atomic -malli Se on Erwin Schrödingerin vuonna 1926 kehittämän atomin toiminta- ja rakenteen ehdotus. Sitä kutsutaan atomin kvanttimekaanisena malli- ja kuvaa elektronin aaltokäyttäytymistä.
Tätä varten erinomainen itävaltalainen fyysikko perustui broglie -hypoteesiin, joka totesi, että jokainen liikkuva hiukkanen liittyy aaltoon ja voi käyttäytyä sellaisenaan.
 Erwin Schrödinger
Erwin Schrödinger Schrödinger ehdotti, että elektronien liikkuminen atomiin vastasi aalto-hiukkasten kaksinaisuutta, ja siten elektronit voivat mobilisoida ytimen ympärillä paikallaan olevina aaltoina.
Schrödinger, joka sai Nobel -palkinnon vuonna 1933, hänen panoksestaan atomiteoriaan, kehitti homonyymin yhtälön laskeakseen todennäköisyyden, että elektroni on tietyssä asemassa.
Schrödinger Atomic -malliominaisuudet
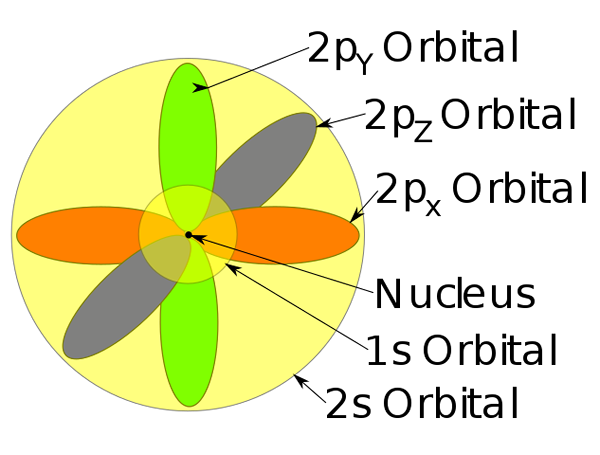 Orbitaalit 1, 2 ja 2p natriumiatomin sisällä.
Orbitaalit 1, 2 ja 2p natriumiatomin sisällä. -Tämä atomimalli kuvaa elektronien liikkumista paikallaan olevina aaltoina.
-Elektronit liikkuvat jatkuvasti, ts. Heillä ei ole kiinteää tai määritettyä asemaa atomin sisällä.
-Tämä malli ei ennusta elektronin sijaintia, eikä se kuvaa sitä reittiä, jonka se tekee atomin sisällä. Määrittää todennäköisyysvyöhykkeen vain elektronin löytämiseksi.
-Näitä todennäköisyysalueita kutsutaan atomiorbitaaleiksi. Orbitaalit kuvaavat translaatioliikettä atomin ytimen ympärillä.
-Näillä atomiorbitaaleilla on erilaiset tasot ja energia -ala -tasot, ja ne voidaan määritellä elektronien pilvien välillä.
-Malli ei harkitse ytimen stabiilisuutta, se tarkoittaa vain atomin elektronien liikkeeseen liittyviä kvantimekaniikkaa.
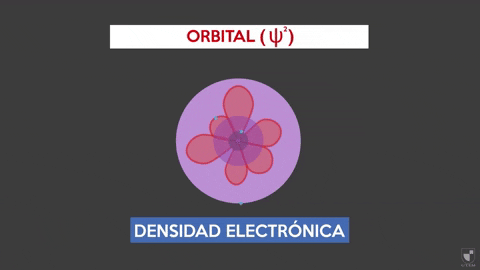 Elektroninen tiheys osoittaa elektronin löytämisen todennäköisyyden ytimen lähellä. Mitä lähempänä ytimestä (violetti vyöhyke), on todennäköistä enemmän, kun taas se on vähemmän, jos siirryt pois ytimestä (violetti -alue).
Elektroninen tiheys osoittaa elektronin löytämisen todennäköisyyden ytimen lähellä. Mitä lähempänä ytimestä (violetti vyöhyke), on todennäköistä enemmän, kun taas se on vähemmän, jos siirryt pois ytimestä (violetti -alue). Koe
Schrödingerin atomimalli perustuu Broglie -hypoteesiin sekä Bohrin ja Sommerfeldin aikaisempiin atomimalleihin.
Voi palvella sinua: dynaaminen tai kineettinen kitka: Kerroin, esimerkit, harjoituksetBroglie ehdotti, että aivan kuten aalloilla on hiukkasia, hiukkasilla on aaltoominaisuuksia, joilla on siihen liittyvä aallonpituus. Jotain, joka tuotti tuolloin paljon odotuksia, koska hän oli Albert Einstein itse hänen teoriassaan.
Broglien teorialla oli kuitenkin puute, mikä oli, että oman idean merkitystä ei ymmärretty kovin hyvin: elektroni voi olla aalto, mutta entä mitä? Silloin Schrödingerin luku näyttää vastaavan.
Tätä varten itävaltalainen fyysikko luottaa Youngin kokeiluun ja omien havaintojensa perusteella hän kehitti hänen nimensä kantavan matemaattisen ilmaisun.
Seuraavaksi tämän atomimallin tieteelliset perustat:
Youngin kokeilu: Aaltopartikkelin ensimmäinen osoitus
Broglie -hypoteesi kohteen aaltoilevasta ja korpuskulaarisesta luonteesta voidaan osoittaa Youngin kokeella, joka tunnetaan myös nimellä Double Slit -koe.
Englantilainen tiedemies Thomas Young loi perustan Schrödingerin atomimalliin, kun hän suoritti vuonna 1801 kokeen valon aaltoilevan luonteen tarkistamiseksi.
Kokeilunsa aikana Young jakoi valonsäteen säteilyn, joka ylittää pienen reiän havaintokammion läpi. Tämä jako saavutetaan käyttämällä 0,2 millimetrin korttia, joka sijaitsee palkin suuntaisesti.
Kokeen suunnittelu tehtiin valonsäteen leveämmäksi kuin kortti, asettamalla kortin vaakasuoraan, palkki jaettiin suunnilleen samoihin osiin. Valonpalkkien poistuminen ohjasi peili.
Voi palvella sinua: EtäisyysvoimatMolemmat valonsäteet osuivat seinään pimeässä huoneessa. Siellä näiden kahden aallon välinen häiriökuvio osoitettiin, mikä osoitettiin, että valo voisi käyttäytyä yhtä paljon kuin hiukkaset ja aalto.

Vuosisataa myöhemmin Albert Einsten vahvisti ideaa kvanttimekaniikan periaatteiden avulla.
Schrödingerin yhtälö
Schrödinger kehitti kaksi matemaattista mallia, erottaen sen, mitä tapahtuu riippuen siitä, muuttuuko kvanttitila ajan myötä vai ei.
Atomianalyysiä varten Schrödinger julkaisi vuoden 1926 lopulla.
Tämä tarkoittaa, että aalto ei liiku, sen solmut, toisin sanoen sen tasapainopisteet, toimivat käännöksenä muun rakenteen liikkumiseen niiden ympäri, kuvaamalla tiettyä taajuutta ja amplitudia.
Schrödinger määritteli aallot, jotka kuvaavat elektroneja paikallaan tai kiertoradalla, ja niihin liittyvät puolestaan eri energiatasoilla.
Schrödingerin riippumaton aikayhtälö on seuraava:
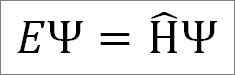
Missä:
JA: Suhteellisuusvakio.
Ψ: Kvanttijärjestelmän aaltofunktio.
Η ̂: Hamiltonian operaattori.
Schrödingerin riippumatonta aikayhtälöä käytetään, kun Hamiltonian operaattorina tunnetun järjestelmän kokonaisenergiaa edustava havaittavissa oleva ei riipu ajasta. Aallon kokonaisliikkeeseen kuvaava funktio riippuu kuitenkin aina ajasta.
Schrödingerin yhtälö osoittaa, että jos sinulla on aaltofunktio ψ, ja Hamiltonin operaattori toimii siihen, suhteellisuusvakio ja edustaa kvanttijärjestelmän kokonaisenergiaa yhdessä sen kiinteissä tilassa.
Se voi palvella sinua: Diskreetti muuttuja: Ominaisuudet ja esimerkitSchrödingerin atomimalliin sovelletaan, jos elektroni liikkuu määritellyssä tilassa, on erillisiä energia -arvoja ja jos elektronia siirretään vapaasti avaruudessa, jatkuvia energiavälejä on ollut.
Matemaattisesta näkökulmasta Schrödinger -yhtälölle on useita ratkaisuja, kukin ratkaisu merkitsee erilaista arvoa suhteellisuusvakiolle ja.
Heisenbergin epävarmuusperiaatteen mukaan elektronin sijaintia tai energiaa ei ole mahdollista arvioida. Tämän seurauksena tutkijat tunnustavat, että elektronin sijainnin arvio atomin sisällä on epätarkka.
Schrödinger -atomimallin postulaatit
Schrödinger -atomimallin postulaatit ovat seuraavat:
-Elektronit käyttäytyvät paikallaan olevina aaltoina, jotka jakautuvat avaruuteen aaltofunktion ψ mukaisesti.
-Elektronit liikkuvat atomin sisällä, joka kuvaa kiertorataa. Nämä ovat alueita, joilla elektronin löytämisen todennäköisyys on huomattavasti korkeampi. Edellä mainittu todennäköisyys on verrannollinen aaltofunktion neliöön ψ2.
Schrödinguer -atomimallin elektroninen konfiguraatio selittää muodon atomien ja linkkien jaksolliset ominaisuudet.
Schrödingerin atomimalli ei kuitenkaan harkitse elektronien spiniä eikä ota huomioon nopeiden elektronien variaatioita relativististen vaikutusten aiheuttamista relativistisista vaikutuksista.
Kiinnostavia artikkeleita
Broglie -atomimalli.
Chadwick Atomic -malli.
Heisenberg Atomic -malli.
Perrin Atomic -malli.
Thomson Atomic -malli.
Dalton Atomic -malli.
Dirac Jordan Atomic -malli.
Democritus Atomic -malli.
Leucpo -atomimalli.
Bohr -atomimalli.
Sommerfeld Atom -malli.
Nykyinen atomimalli.
Viitteet
- Atomin kvantmekaaninen malli.Khanacademy.org
- Schrödingerin aaltoyhtälö (S.F.-A. Jaime I -yliopisto. Castellón, Espanja. Palautettu: Uji.On
- Moderni atomiteoria: mallit. © Abcte. Toipunut: Abcte.org
- Schrodingerin atomi mod.F.-A. Palautettu: Erwinschrodingerbiografia.Pikkuhenkilö.com
- Wikipedia, ilmainen tietosanakirja. Schrödinger -yhtälö. Palautettu: on.Wikipedia.org
- Wikipedia, ilmainen tietosanakirja. Nuori koe. Palautettu: on.Wikipedia.org

