Thomson -atomien mallin ominaisuudet, postulaatit, subatomiset hiukkaset
- 966
- 181
- Louis Moen
Hän Thomson Atomic -malli Sen on luonut englantilainen fyysinen juhla j. J -. Thomson, joka löysi elektronin. Tämän löytön ja sen kaasujen sähköjohtavuutta koskevat teokset palkittiin vuonna 1906 Nobel -palkinnon kanssa fysiikassa.
Hänen työstään katodisäteiden kanssa paljastettiin, että atomi ei ollut jakamattoman kokonaisuus, kuten Dalton oli oletettu edellisessä mallissa, mutta että se sisälsi hyvin määritellyn sisäisen rakenteen.

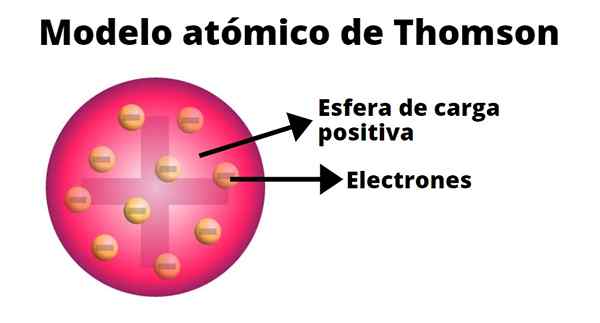
Thomson kehitti atomimallin, joka perustuu hänen kokeidensa tuloksiin katodisäteillä. Hänessä hän vakuutti, että atomi, sähköisesti neutraali, muodostettiin positiivisista ja negatiivisista varauksista.
[TOC]
Mikä oli Thomsonin atomimallin nimi ja miksi?
Thomsonin mukaan positiivinen kuorma jakautui koko atomiin ja negatiiviset maksut upotettiin siihen ikään kuin ne olisivat vanukan rusinoita. Tästä vertailusta tuli termi "rusisin vanukas", koska malli oli epävirallisesti tunnettu.
 Joseph John Thomson
Joseph John Thomson Vaikka Thomsonin idea on tällä hetkellä melko primitiivinen, hän edusti aikansa uutta panosta. Mallin lyhyen pätevyyden aikana (vuosina 1904–1910) hänellä oli monien tutkijoiden tuki, vaikka monet muut pitivät sitä harhaoppina.
Lopuksi vuonna 1910 syntyi uusia todisteita atomirakenteesta ja Thomsonin malli pysyi nopeasti syrjään. Tämä tapahtui heti, kun Rutherford julkaisi dispersiokokeidensa tulokset, jotka osoittivat atomiytimen olemassaolon.
Thomsonin malli oli kuitenkin ensimmäinen, joka postuloi subatomisia hiukkasia ja niiden tulokset olivat hienon ja tiukan kokeilun hedelmät. Tällä tavoin hän muodosti ennakkotapauksen kaikille seuranneille löytöille.
Thomson -mallin ominaisuudet ja postulaatit
Thomson saapui hänen atomismalliinsa useiden havaintojen perusteella. Ensimmäinen oli se, että Roentgenin äskettäin löytämät X -rajat pystyivät ionisoimaan ilmamolekyylejä. Siihen asti ainoa tapa ionisoitumiseen oli kemiallisesti erottaminen liuokseen.
Mutta englantilainen fyysikko onnistuneesti ionisoi jopa monooatoisia kaasuja, kuten heliumia, x -rakojen kautta. Tämä sai hänet uskomaan, että atomin sisällä oleva kuorma voitaisiin erottaa ja että se ei ollut jakamattomia.Hän havaitsi myös, että katodisäteet voidaan ohjata sähkö- ja magneettikentällä.
 J -.J -. Thomson, elektronin löytäjä. Lähde: Lafer.
J -.J -. Thomson, elektronin löytäjä. Lähde: Lafer. Sitten Thomson suunnitteli mallin, joka selitti oikein tosiasian, että atomi on sähköisesti neutraali ja että katodisäteet koostuvat hiukkasista, joilla on negatiivinen kuormitus.
Karvittaessa kokeellista näyttöä, Thomson karakterisoi atomin seuraavasti:
-Atomi on sähköisesti neutraali kiinteä pallo, likimääräinen säde 10-10 m.
-Positiivinen kuorma jakautuu enemmän tai vähemmän tasaisesti pallo.
-Atomi sisältää negatiivisesti lastattuja "korisuhteita", jotka varmistavat niiden puolueettomuuden.
-Nämä korit ovat samat kaikissa aineissa.
-Kun atomi on tasapainossa, on n CORPUSCLES SOJOITUKSET SILMÄT RENKAT Positiivisen kuormituspallon sisällä.
-Atomin massa on jakautunut tasaisesti.
Katodisäteet
 Elektronisäde on suunnattu katodista anodiin.
Elektronisäde on suunnattu katodista anodiin. Thomson suoritti kokeilunsa katodisäteillä, jotka löydettiin vuonna 1859. Katodisäteet ovat negatiivisesti varautuneita hiukkasia. Niiden tuottamiseksi käytetään tyhjiökideputkia, joihin asetetaan kaksi elektrodia, joita kutsutaan katodi ja anodi.
Voi palvella sinua: Magnetismi: materiaalien magneettiset ominaisuudet, käyttötarkoituksetSitten ohitetaan sähkövirta, joka lämmittää katodin, joka säteilee siten näkymättömän säteilyn, joka on suunnattu suoraan vastakkaiseen elektrodiin.
Säteilyn havaitsemiseksi, mikä ei ole muuta kuin katodisäteet, putken seinä on peitetty fluoresoivalla materiaalilla. Kun säteily tulee sinne, putken seinä antaa voimakkaan kirkkauden.
Jos kiinteä esine on sijoitettu katodisäteiden polulle, se heittää varjon putken seinämään. Tämä osoittaa, että säteet kulkevat suorassa linjassa ja myös, että ne voivat helposti estää ne.
Katodisäteiden luonteesta keskusteltiin laajasti, koska sen luonne oli tuntematon. Jotkut ajattelivat, että ne olivat sähkömagneettisia aaltoja, kun taas toiset väittivät olevansa hiukkasia.
Subatomiset hiukkaset Thomson Atomic -malli
Thomsonin atomimalli on, kuten totesimme, ensimmäinen postultoi subatomisia hiukkasten olemassaoloa. Thomsonin ruumiit eivät ole mitään muuta kuin elektronit, negatiivisesti ladattujen atomin perushiukkaset.
Tiedämme tällä hetkellä, että kaksi muuta perushiukkaa ovat protoni, positiivisesti ladattu ja neutroni ilman kuormaa.
Mutta näitä ei löydetty tuolloin, kun Thomson kehitti mallia. Atomin positiivinen varaus jakautui siihen, ei ottanut huomioon mitään hiukkasia, jotka kantoivat mainittua kuormaa, eikä tällä hetkellä ollut todisteita sen olemassaolosta.
Tästä syystä hänen mallillaan oli ohimenevä olemassaolo, koska muutaman vuoden kuluessa Rutherfordin dispersiokokeet avasivat tien protonin löytämiselle. Ja mitä neutronia, Rutherford itse ehdotti olemassaoloaan muutama vuosi ennen kuin hänet lopulta löydettiin.
Crookes -putki
Sir William Crookes (1832-1919) suunnitteli putken, joka kantaa hänen nimensä noin vuonna 1870, tarkoituksena tutkia huolellisesti katodisäteiden luonnetta. Hän lisäsi sähkökenttiä ja magneettikenttiä ja havaitsi, että näillä oli säteitä.
 Katodisäteputki. Lähde: Knight, R.
Katodisäteputki. Lähde: Knight, R. Tällä tavalla Crookes ja muut tutkijat, mukaan lukien Thomson, havaitsivat sen:
- Katodisäteputken sisällä syntyi sähkövirta
- Säteitä poikkeaa magneettikenttien läsnäolosta samalla tavalla kuin negatiivisesti varautuneet hiukkaset olivat.
- Kaikki katodin valmistukseen käytetyt metallit olivat yhtä hyvin katodisäteiden tuottamiseksi, ja niiden käyttäytyminen oli riippumaton materiaalista.
Nämä havainnot ruokkivat keskustelua katodisäteiden alkuperästä. Ne, jotka väittivät olevansa aaltoja. Lisäksi tämä hypoteesi selitti erittäin hyvin varjon, jonka interisoitu kiinteä esine heitti putken seinämään ja tietyissä olosuhteissa tiedettiin, että aallot voivat aiheuttaa fluoresenssia.
Mutta sen sijaan ei ymmärretty, kuinka oli mahdollista, että magneettikentät ohjasivat katodisäteet. Tällä oli selitys vain, jos näitä säteitä pidettiin hiukkasina, hypoteesina, jonka Thomson jakoi.
Hiukkaset ladattu tasaisiin sähkö- ja magneettikenttiin
Q -kuormituksella ladattu hiukkaset kokevat uskon voiman tasaisen sähkökentän keskellä ja suuruusluokkaan:
Voi palvella sinua: Valon aaltoileva teoria: Selitys, sovellukset, esimerkitUsko = QE
Kun ladattu hiukkanen ylittää kohtisuorasti tasaisen sähkökentän, kuten sen, joka tapahtuu kahden levyn välillä, joilla on vastakkaiset kuormat, se kokee poikkeaman ja siksi kiihtyvyyden:
QE = MA
A = QE/M
Toisaalta, jos ladattu hiukkas liikkuu suuruudella V -nopeudella, tasaisen magneettikentän B keskellä, kokemuksellisella magneettisella FORS FM: llä on seuraava intensiteetti:
Fm = qvb
Niin kauan kuin nopeus- ja magneettikentän vektorit ovat kohtisuorassa. Kun ladattu hiukkas vaikuttaa kohtisuoraan homogeenisessa magneettikentässä, se kokee myös poikkeaman ja sen liike on tasainen pyöreä.
Centripetaalinen kiihtyvyysc Tässä tapauksessa se on:
QVB = MAc
Centripetaalinen kiihtyvyys puolestaan liittyy hiukkasen V nopeuteen ja pyöreän radan säteeseen R:
-llac = v2/R
Siksi:
Qvb = mv2/R
Pyöreän radan säde voitaisiin laskea seuraavasti:
R = mv/qb
Myöhemmin näitä yhtälöitä käytetään uudelleen tapaan, jolla Thomson päätti elektronikuormitus-mandy-suhteen.
Thomsonin kokeilu
Thomson ohitti katodisäteiden, elektronien säteen, vaikka hän ei vieläkään tiennyt, yhtenäisten sähkökenttien kautta. Nämä kentät luodaan kahden johtavan levyn väliin, jotka on ladattu ja erotetaan pienellä etäisyydellä.
Katodisäteet kulkivat myös tasaisen magneettikentän läpi tarkkailemalla vaikutusta, joka tällä oli palkkiin. Sekä yhdellä kentällä että toisella säteillä oli taipuma, joka johti Thomsonin ajattelemaan perustellusti, että säde koostui varautuneista hiukkasista.
Tarkistaaksesi Thomson suoritti useita strategioita katodisäteillä:
- Vaihtele sähkö- ja magneettikenttiä, kunnes voimat peruutettiin. Tällä tavoin katodisateet kulkivat läpi kokeilematta taipumaa. Vastaavat sähkö- ja magneettiset voimat, Thomson onnistui määrittämään säteen hiukkasten nopeuden.
- Kumosi sähkökentän voimakkuuden, tällä tavalla hiukkaset seurasivat pyöreää suuntausta magneettikentän keskellä.
- Yhdistettynä vaiheiden 1 ja 2 tulokset "CORPUSCLES" kuormitus-mandy-suhteen määrittämiseksi.
Elektronien lastimassasuhde
Thomson päätti, että katodisäteiden säteen muodostavien hiukkasten lastinsuhde on seuraava arvo:
Q/m = 1.758820 x 10 11 c.KG-1.
Missä Q edustaa "korpuskisen" kuormaa, joka on oikeastaan elektroni ja m Se on saman massa. Thomson noudatti edellisessä osassa kuvattua menettelyä, jonka olemme täällä uudelleen askel askeleelta, hänen käyttämiensä yhtälöiden kanssa.
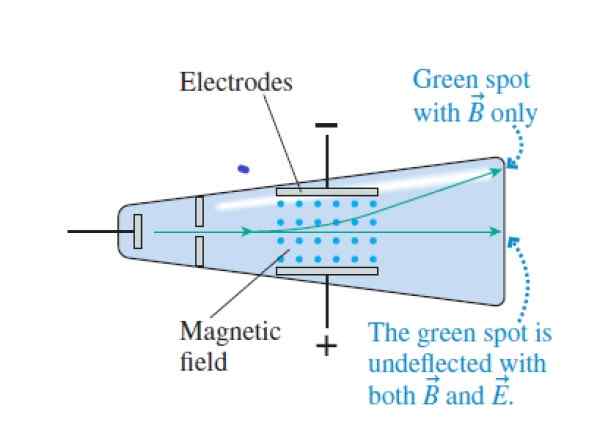 Kun katodisäteet ylittävät risti- ja magneettikentät, ne kulkevat ilman taipumaa. Kun sähkökenttä peruutetaan, ne vaikuttavat putken yläosaan (magneettikenttä on merkitty sinisillä pisteillä elektrodien välillä). Lähde: Knight, R.
Kun katodisäteet ylittävät risti- ja magneettikentät, ne kulkevat ilman taipumaa. Kun sähkökenttä peruutetaan, ne vaikuttavat putken yläosaan (magneettikenttä on merkitty sinisillä pisteillä elektrodien välillä). Lähde: Knight, R. Vaihe 1
Yhdistä sähkövoima ja magneettinen voima, joka kulkee säteen kohtisuorien sähkö- ja magneettikenttien läpi:
Qvb = qe
Vaihe 2
Määritä säteen hiukkasten hankkima nopeus, kun ne kulkevat suoraan ilman taipumaa:
V = e/b
Vaihe 3
Peruuta sähkökenttä jättäen vain magneettikentän (nyt taipuma):
R = mv/qb
V = E/B -tulokset:
R = me/qb2
Kiertoradan säde voidaan mitata, siksi:
Q/M = V/RB
O No:
Q/M = E/RB2
Seuraavat vaiheet
Seuraava asia, jonka Thomson teki. Kuten edellä todettiin, kaikki metallit päästivät katodisäteet, joilla on identtiset ominaisuudet.
Voi palvella sinua: induktiivinen reaktanssiSitten Thomson vertasi arvojaan vetyionin Q/M -suhteessa, joka on saatu elektrolyysillä ja jonka arvo on noin 1 x 108 C/kg. Elektronikuormitus-MASA-osamäärä on noin 1750 kertaa suurempi kuin vety-ioni.
Siksi katodisäteillä oli paljon suurempi kuormitus tai ehkä paljon pienempi massa kuin vety -ioni. Vety -ioni on yksinkertaisesti protoni, jonka olemassaolo oli tiedossa Rutherfordin dispersiokokeiden jälkeen.
Nykyään tiedetään, että protoni on melkein 1800 kertaa massiivisempi kuin elektroni ja yhtä suuren suuruuden ja merkin kanssa ristiriidassa elektronin kanssa.
Toinen tärkeä yksityiskohta on, että Thomsonin kokeissa elektronin sähkövarausta ei määritetty, eikä sen massan arvo erikseen. Nämä arvot määritettiin Millikanin kokeilla, jotka alkoivat vuonna 1906.
Thomson- ja Dalton -mallit eroja
Näiden kahden mallin perustavanlaatuinen ero on, että Dalton ajatteli, että atomi on pallo. Vastoin Thomsonia, hän ei ehdottanut positiivisten tai negatiivisten maksujen olemassaoloa. Daltonille atomi oli näin:
 Dalton Atom
Dalton Atom Kuten olemme aiemmin nähneet, Thomson ajatteli, että atomi oli jaettavissa ja jonka rakenne muodostuu positiivisesta pallo ja elektronit ympärillä.
Mallivirheet ja rajoitukset
Tuolloin Thomsonin atomimalli onnistui selittämään aineiden kemiallisen käyttäytymisen erittäin hyvin. Hän selitti myös perustellusti katodin sädeputkessa tapahtuneet ilmiöt.
Mutta itse asiassa Thomson ei edes kutsunut "elektronien" hiukkasiaan, vaikka termi oli jo aiemmin keksinyt George Johnstone Stoney. Thomson kutsui heitä yksinkertaisesti "Corpuscles".
Vaikka Thomson käytti kaikkia tietoja, jotka hänellä oli tällä hetkellä, hänen mallissaan on useita tärkeitä rajoituksia, jotka olivat hyvin ilmeisiä:
-Positiivinen kuorma ei ole jakautunut koko atomiin. Rutherfordin dispersiokokeet osoittivat, että atomin positiivinen kuormitus rajoittuu välttämättä pieneen alueeseen, josta tuli myöhemmin tunnetuksi atomiydin nimellä.
-Elektronien erityinen jakauma kussakin atomisessa. Elektronit eivät ole tasaisesti jakautuneet, kuten kuuluisan buddiinin rusinat, mutta niillä on luovutus kiertoradalla, jotka seuraavat mallit osoittivat.
Juuri elektronien sijoittaminen atomiin sallii elementtien järjestämisen niiden ominaisuuksien ja ominaisuuksien suhteen jaksollisessa taulukossa. Tämä oli Thomson -mallin tärkeä rajoitus, joka ei pystynyt selittämään, kuinka elementit oli mahdollista tilata tällä tavalla.
-Atomien ydin on se, joka sisältää suurimman osan taikinasta. Thomsonin malli postuloi, että atomin massa jakautui tasaisesti sisälle. Mutta tänään tiedämme, että atomin massa on käytännössä keskittynyt ytimen protoneihin ja neutroneihin.
On myös tärkeää korostaa, että tämä atomimalli ei sallinut sen liikkeen tyypin päättämistä, joita elektronit olivat atomin sisällä.
Kiinnostavia artikkeleita
Schrödinger Atomic -malli.
Broglie -atomimalli.
Chadwick Atomic -malli.
Heisenberg Atomic -malli.
Perrin Atomic -malli.
Dalton Atomic -malli.
Dirac Jordan Atomic -malli.
Democritus Atomic -malli.
Leucpo -atomimalli.
Bohr -atomimalli.
Sommerfeld Atom -malli.
Nykyinen atomimalli.
Viitteet
- Andriessen, M. 2001. HSC -kurssi. Fysiikka 2. Jacaranda HSC Science.
- Arfken, G. 1984. Yliopistofysiikka. Akateeminen lehdistö.
- Ritari, r. 2017. Tutkijoiden fysiikka ja tekniikka: strategialähestymistapa. Pearson.
- Rex, a. 2011. Fysiikan perusteet. Pearson.
- Wikipedia. Thomson Atomic -malli. Palautettu: se on.Wikipedia.org.
- « Yleiset kaava neliöyhtälöt, esimerkit, harjoitukset
- Dirac Jordan -ominaisuuksien ja postulaattien AOMIC -malli »

