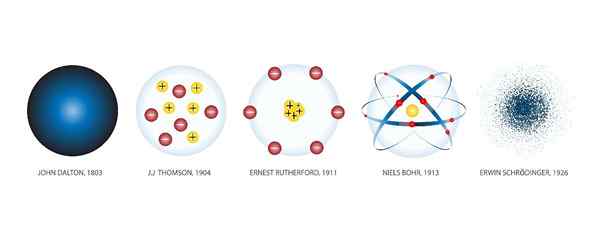
Atomimallit
- 2657
- 560
- Kelly Kilback
 Atomimallit ovat erilaisia graafisia esityksiä, jotka on annettu atomille historian ajan. Suljettu
Atomimallit ovat erilaisia graafisia esityksiä, jotka on annettu atomille historian ajan. Suljettu Mitkä ovat atomimallit?
Se Atomimallit Ne ovat graafisia esityksiä atomin rakenteesta ja toiminnasta. Koko historian aikana on ollut lukuisia malleja.
Tämä johtuu siitä, että ajatus atomista perustavanlaatuisena lohkona, jonka asia on tehty, syntyi tuhansia vuosia sitten, muinaisessa Kreikassa. Tuolloin atomi oli vain filosofisen spekulaation tuote.
Kun uusia tieteellisiä löytöjä tehtiin, luotiin uusia malleja hankitun tiedon sisällyttämiseksi. Ja niin se on tapahtunut vuosisadan jälkeen tähän päivään asti, jolloin tekniikka on antanut meille mahdollisuuden tarkkailla atomeja mikroskoopien kautta ja määrittää oikea malli.
Mitkä ovat atomit?
Atomit ovat submikroskooppisia rakenteita, joista kaikki havaitsemme aiheet, joiden kanssa olemme vuorovaikutuksessa joka päivä, omasta kehostamme, syömämme ruoan, vaatteiden, vaatteiden, suurten pilvenpiirtäjien ja lentokoneiden kanssa.
Myös aurinko, kuu, planeetat, tähdet ja galaksit muodostuvat atomilla.
Nämä ovat niin pieniä, että niitä ei voida nähdä yhteisillä mikroskoopeilla. Muita vaaditaan suuremmasta voimasta, nimeltään ultramikroskooppeja. Atomit eivät kuitenkaan ole pienimpiä luonnon yksiköitä.
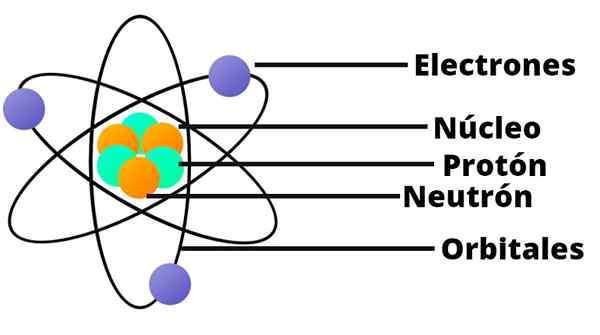
Atomit muodostuvat puolestaan jopa pienemmillä hiukkasilla: protonit, neutronit ja elektronit.
Protoneilla on positiivinen sähkövaraus, kun taas neutroneilla ei ole sähkövarausta. Nämä kaksi hiukkastyyppiä muodostavat atomin ytimen.
Ytimen ympärillä pyörivät auringon ympärillä olevat elektronit, joilla on negatiivinen sähkövaraus.
Atomimalli demokraattinen

Abderan demokraatti oli kreikkalainen filosofi, joka asui välillä 460–370 ennen nykyistä aikakautta. Hän vakuutti, että kaiken aineen muodostivat pienet hiukkaset, joita hän kutsui atomeiksi, mikä kreikkalaiseksi tarkoittaa jakamattomia.
Democrituksen mukaan atomi on pienin osa, johon asia voidaan jakaa. Niitä on ääretön määrä, jotka ovat tuhoutumattomia, uskomattomia, iankaikkisia ja ehdottoman kompakteja, ilman huokosia. On olemassa useita tyyppejä, jotka eroavat muodoltaan, suuruudesta, sijainnista ja tapaan, jolla he ovat halukkaita.
Se voi palvella sinua: ihmisen aiheuttamat katastrofit tiedettä ja tekniikkaa käytettäessäAristoteles hylkäsi Democrituksen teorian ja unohti sitten täysin nykyaikaisen tieteen syntymiseen asti.
Dalton Atomic -malli

John Dalton (1766-1844) oli englantilainen meteorologi, joka oli kiinnostunut tutkimaan kaasun käyttäytymistä hallitsevia lakeja. Hedelmät hänen työstään tällä alalla olivat ensimmäinen modernin tieteen atomimalli, jonka hän teki vuonna 1803.
Koska protonien ja elektronien olemassaoloa ei ollut vielä löydetty, Dalton sanoi, kuten Democritus, että atomi on pienin osa, jossa asia voidaan jakaa, ja siksi se sinänsä on jakaminen.
Daltonin mukaan atomit ovat kiinteitä ja pallomainen muoto, kuten baseball -pallo. Dalton kuvasi hänen teoriansa veistämistä puussa yhdessä avustajiensa kanssa kymmeniä palloja, jotka edustivat eri kemiallisten elementtien atomeja.
Tämä malli oli voimassa elektronin löytämiseen asti.
Thomson Atomic -malli
Englantilaisen fyysikon Joseph John Thomsonin (1865-1940) piti tehdä yksi nykyaikaisen tieteen tärkeimmistä löytöistä: Elektronista.
Se oli vuonna 1897, Cambridgen yliopiston Cavendish -laboratoriossa Englannissa, missä plakki muistaa edelleen suurta löytöä.
Thompson ja hänen avustajansa projisoivat katodisäteitä sähkökentällä. Kosketuksessa kentän kanssa säteet poikkeaivat laajojen kulmien muodostamisesta. Tämä vahvisti, että katodisäteillä oli negatiivinen sähkövaraus. Ne negatiivisesti varautuneet hiukkaset kutsuivat niitä elektroneiksi.
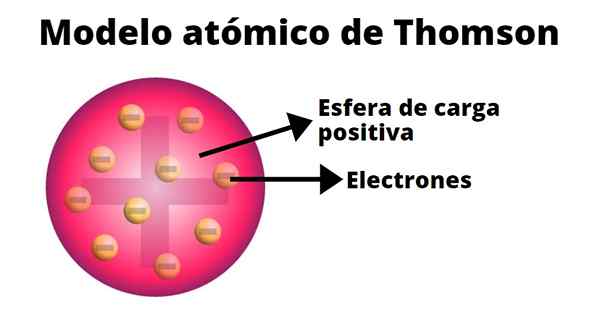
Thomson oletti, että elektronit upotettiin atomiin. Hänen atomimalli on vuodesta 1904.
Rännien vanukas
Thompsonin atomimallissa atomi on kiinteä pallo, jolla on positiivinen kuorma (protonit), joihin neutronit (negatiivinen kuorma) jakautuvat satunnaisesti, kun pudiiniin heitetään rusinoita. Siksi tämä malli tunnetaan nimellä "Pudin de pasas".
Thompsonin mukaan atomin säde on 0,00000001 senttimetriä ja sen kuorma on neutraali, koska protoneilla ja elektronilla on sama kuorma, mutta päinvastoin.
Thompson -malli ei esiinny neutroneja.
Rutherford Atomic -malli
Neozylean-fyysikko Ernest Rutherford (1871-1937) oli yksi Thomsonin näkyvimmistä opiskelijoista.
Voi palvella sinua: korrelaatiotutkimusVuonna 1911, ja perustuen silloiseen radioaktiivisuuden löytämiseen Rutherford suoritti seuraavan kokeen: he ampuivat suuren nopeuden ja energian alfa -radioaktiivisia hiukkasia kultaarkkia vastaan.
Jos Thompson -atomimalli olisi oikea, alfahiukkaset kulkevat arkin läpi poikkeamatta tai merkityksettömällä poikkeamalla. Kuitenkin, kun he laskivat poikkeamakulman hiukkasista, he huomasivat, että se oli leveä ja että jotkut jopa pomppivat kultaista arkkia vasten.
Tämän tuloksen avulla Rutherford ymmärsi, että atomilla tulisi olla hyvin pieni ja erittäin tiivistetty ydin. Tämä ydin oli positiivisesti varautunut.
Pieni aurinkokunta
Rutherfordin atomimalli on kuin miniatyyri aurinkokunta. Keskustassa, paikassa, joka vastaa aurinkoa, on ydin, jossa on positiivisesti ladattuja protoneja. Tämän ympärillä, kiertäen planeettoja, on satunnaisesti hajautettuja elektroneja.
Rutherford totesi myös, että atomin massa vastaa elektroni- ja protonien massaa.
Bohr -atomimalli
Vaikka Rutherford -malli oli kiistaton etu aikaisempien mallien suhteen, sillä oli tärkeitä vikoja. Esimerkiksi, jos elektronit tehokkaasti kiertävät ytimen ympärillä, ne menettäisivät energiaa ja romahtavat ytimeen. Mutta tätä ei selvästikään tapahtunut.
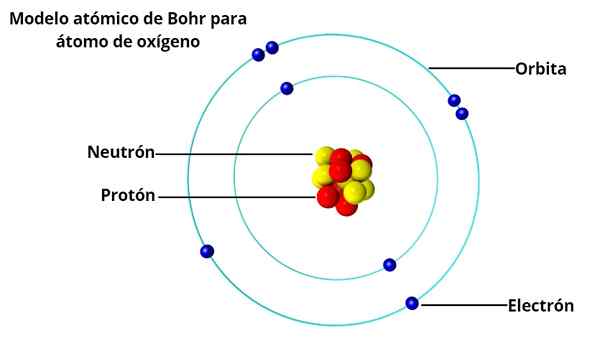
Tanskalainen fyysikko Niels Bohr (1885-1962), Manchesterin yliopiston Rutherfordin opiskelijan (Englanti) opiskelija, joka ehdotti vuonna 1913 atomimallia, joka ratkaisi hänen vanhan professorinsa aiheuttamat ongelmat.
Pyöreät kiertoradat
BOHR: n atomismallissa elektronit eivät kiertäisi vapaasti ytimen ympärillä, vaan tekevät niin stabiileilla pyöreillä kiertoradalla, erotettuna toisistaan tietyllä etäisyydellä, samanlainen kuin kuinka aurinkokunnan planeetat on järjestetty. Jokaista kiertorata kutsutaan energia- tai energiatasoksi.
Max Planckin ja Albert Einsteinin tutkimusten perusteella hän päätti, että jokaisella heidän kiertoradalla olevalla elektronilla on tietty määrä energiaa.
Kun ytimen ympärillä kiertää vakaa, sanotaan, että elektronit ovat paikallaan. Toisaalta, kun elektroni "hyppää" pienemmälle energian kiertoradalle, on fotonia.
Voi palvella sinua: metodologiaBohr -malli ei kuitenkaan onnistunut selittämään atomien toimintaa useammalla kuin yhdellä elektronilla.
Sommerfeld Atom -malli
Arnold Sommerfeld (1868-1951) oli saksalainen fyysikko, joka omistautui työnsä Bohrin atomimallin laajentamiseen. Tämä laajennettu malli esitettiin vuonna 1916.
Perustuen Einsteinin suhteellisuusteoriaan, Sommerfeld havaitsi, että jotkut elektronit kiertävät ytimen ympärillä valon lähellä (300.000 kilometriä sekunnissa).
Hän teki myös seuraavat muutokset Bohr -malliin:
- Elektronit liikkuvat ytimen ympäri pyöreissä ja elliptisissä kiertoraissa. Bohr tunnisti vain pyöreät kiertoradat.
- Saman energiatason sisällä on al -tasoja, joilla on hieman erilaisia energioita.
Kvanttimekaaninen malli (Broglie, Heisenberg ja Schrödinger)
Tämä on tarkka atomimalli, joka tunnetaan ja on tällä hetkellä hyväksytty, joihinkin seuraaviin lisäyksiin. Sen ovat kehittäneet kolme tutkijaa: saksalainen Werner Heisenberg (1901-1976), itävaltalainen Erwin Schrödinger (1887-1961) ja ranskalainen Louis de Broglie (1892-1987).
Tämä malli hylkää idean elektroneista, jotka kiertävät ytimen. Sen sijaan meillä on elektronisia pilviä, jotka ovat tiloja ytimen ympärillä, joissa on mahdollista löytää elektroni. Tämä käyttäytyy kuin paikallaan oleva aalto.
Sen löytämisen todennäköisyys lasketaan Schrödingerin perustamalla yhtälöllä.
Tämä on atomin kvantmekaaninen malli, joka alkoi Schrödinger -yhtälöstä. Tällä yhtälöllä voit tietää todennäköisyyden löytää elektroni tietyssä atomin kohdassa.
Tässä mallissa jokainen elektroni liikkuu tiettyyn suuntaan, joka määritetään neljällä kvantinumerolla, jotka ovat: pääkvanttinumero, sekundaarinen kvantinumero, magneettinen kvantinumero ja kvantinumero spin.
Ei ole kahta elektronia, joilla on identtisiä kvantinumeroita, kuten fyysikko Wolfgang Paulin löytämä poissulkemisperiaate on todennut.
Viitteet
- (2010). Atomi. Moderni tietosanakirja britti.
- (S. F.-A. Democritus Atomic -malli, filosofinen atomismi. Energian ydinvoiman.netto.
- (S. F.-A. Sommerfeld Atom -malli, laajennus Bohr -malliin. Energian ydinvoiman.netto.
- Bertsch, G. F.; Trefil, James ja McGrayne, Sharon Bertsch (2021). Atomi. Britannica Encyclopedia. Otettu Britannicasta.com.
- Duignan, b. (2021). Demokraatti. Britannica Encyclopedia. Otettu Britannicasta.com.
- New World Encyclopedia -avustajat. (2021). Atomi. Otettu Newworldyclopediasta.org.
- Zita, Ana. (S. F.-A. Atomimallit. Otettu Todamateriasta.com.

