Moleteetti

- 1409
- 169
- Dr. Travis Reichert
Mikä on molealiteetti?
Se Moleteetti, Pienissä kirjaimilla Merkitty M on termi, jota käytetään kuvaamaan liuoksen konsentraatiota. Se voidaan määritellä liuenneen aineen moolien lukumääränä, joka on liuennut 1 kilogrammaan liuottimeen.
Se on yhtä suuri kuin liuenneen aineen moolit (aine, joka liukenee) jaettuna liuotinkelloilla (liukenemiseen käytetty aine).

Missä liuennettua moolia annetaan yhtälöllä:
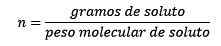
Joten lopulta hiiren yhtälö pysyy
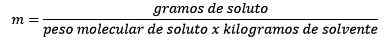
Molealiteetin ominaisuudet
- Molaali on mitta liuenneen aineen pitoisuudesta liuoksessa. Käytetään pääasiassa, kun lämpötila on huolenaihe.
- Molaali ei ole niin yleinen kuin sen vastine, molaarisuus (liuenneen aineen liuottimen moolit liuotin), mutta sitä käytetään hyvin spesifisissä laskelmissa, etenkin kooligatiivisten ominaisuuksien suhteen (kiehumispisteen nousu, jäätymispisteen masennus). Koska tilavuus on lämpötilan ja paineen aiheuttama vaihtelu, molaarisuus vaihtelee myös lämpötilan ja paineen mukaan.
- Joissakin tapauksissa painon käyttö on etu, koska massa ei vaihtele ympäristöolosuhteiden mukaan.
- On tärkeää, että liuotinmassa eikä liuoksen massaa käytetään.
- Moraalisella konsentraatiolla merkityt liuokset on merkitty pienellä kirjaimella m. 1,0 m liuos sisältää 1 mol liuenneen aineen kilogrammaa liuotinta.
- Tietyn moraaliratkaisun valmistelu on helppoa, koska se vaatii vain hyvän mittakaavan. Sekä liuotin että liuennettua ainetta sekoitetaan sen sijaan, että mitataan tilavuudella.
Se voi palvella sinua: propaanihappo- SI -yksikkö (kansainvälinen järjestelmä) on mol/kg tai moolien liuenneaine kg liuotinta. Liuosta, jonka moolio on 1 mol/kg, kuvataan usein nimellä "1 mooli" tai "1 m".
SI -yksikköjärjestelmän seurauksena kansallinen standardien ja tekniikan instituutti, joka on Yhdysvaltojen auktoriteetti mittauksesta, katsoo kuitenkin, että termi "moraalinen" ja "M" -yksikkösymboli ovat vanhentuneita ja ehdottaa MOL/KG: n käyttöä.
Erot ja yhtäläisyydet molealyyden (M) ja molaarisuuden (M) välillä
Tietyn moraalin liuoksen valmistus merkitsee sekä liuenneen että liuottimen punnitsemista ja niiden massojen saamista.
Mutta molaarisuuden tapauksessa mitataan liuoksen tilavuus, joka jättää tilaa tiheysvaihteluille ympäristö- ja paineolosuhteiden seurauksena.
Tämä tarkoittaa, että se on etenevä paine, kun taikina pysyy muuttumattomana.
Lisäksi kemialliset reaktiot tapahtuvat massasuhteessa, ei tilavuudessa. Luottaakseen taikinaan, molealoudesta voi helposti tulla massasuhde tai massaosuus.
Vesipitoisiin liuoksiin (liuokset, joissa vesi on liuotin) lähellä ympäristön lämpötilaa, ero moraalisten ja molaaristen liuosten välillä on halveksittava.
Tämä johtuu siitä, että ympäristön lämpötilan ympärillä veden tiheys on 1 kg / l. Tämä tarkoittaa, että "molaarisuuden" by l "on yhtä suuri kuin" kg: n "molealouden mukaan.
Se voi palvella sinua: Kalsiumkassiinaali: rakenne, ominaisuudet, hankkiminen ja käyttäminenLiuottimelle, kuten etanolille, jossa tiheys on 0,789 kg / l, 1 M liuos olisi 0,789 m.
Tärkeä osa eron muistamisessa on:
Molaarisuus - M → Moolit litraa kohti liuosta.
Molaali - M → Moolit kilogrammaa liuotinta.
Esimerkkejä moleajuudesta
Esimerkki 1
Ongelma: Mikä on 0: n sisältävän ratkaisun moraali.086 NaCl -moolia liuennettiin 25,0 g vettä?
Vastaus: Tässä esimerkissä käytetään suoraa moraalista yhtälöä:
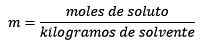
Liuenneen aineen (NaCl) moolit = 0,086 mol
Massa (vesi) = 25,0 g = 25,0 x 10-3 kg
Korvaat:
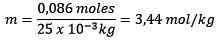
Esimerkki 2
Ongelma: Mikä on liuoksen moraali, jos 124,2 grammaa NaOH: ta liukenee 1,00 litraan vettä? (Vesitiheys on yhtä suuri kuin 1,00 g/ml).
Vastaus: Vesi tunnetaan yleinen liuotin ja tiheys annetaan yleensä noin 1,00 grammaa millilitraa kohti tai mikä on sama, 1 kilogramma litralta. Tämä helpottaa muuntamista litrasta kilogrammiin.
Tässä ongelmassa NaOH: n 124,2 grammaa on muutettava mooliksi (liuenneen aineen moolien) ja litran vettä on muutettava kilogrammiksi (liuotinten kilogrammilla) tiheyden avulla.
Ensinnäkin Naohin massa on:
PNaa= 22,99 g/mol
PJOMPIKUMPI= 16 g/mol
PH= 1 g/mol
PNaoh= 22,99 g/mol +16 g/mol +1 g/mol = 39,99 g/mol
Toiseksi NaOH: n grammat muuttuvat mooliksi molaarisen taikinan avulla:
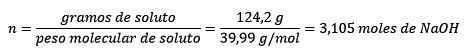
Kolmanneksi, veden litrasta tulee kilogrammia tiheyttä käyttämällä:
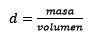
Taikinan puhdistaminen, pysyy:
Voi palvella sinua: Kultaoksidi (III) (AU2O3): Mikä on, rakenne, ominaisuudet, käyttää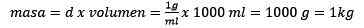
Lopuksi, molelismiyhtälö on ratkaistu:
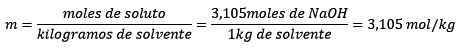
Esimerkki 3
Ongelma: Mikä on vesiliuoksen vesimassa, joka sisältää 0,52 grammaa bariumkloridia (BACL2, PM = 208,23 g/mol), jonka konsentraatio on 0,005 mol/kg?
Vastaus: Tässä tapauksessa moraalikonsentraatiota käytetään veden määrän määrittämiseen liuoksessa.
Ensinnäkin saadaan BACL: n moolien lukumäärä2 Liuoksessa:
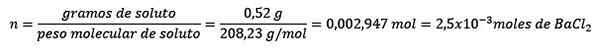
Toiseksi liuottimen kilogrammit puhdistetaan molelismiyhtälöstä ja ratkaistu.
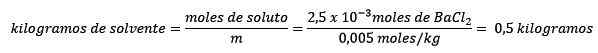
Viitteet
- Laskemalla molaation esimerkki -ongelma. Scientiveteistä toipunut.org.
- Mikä on esimerkki molaaisuudesta? Sokratia.org.
- (S.F.-A. Moraali. Rajattomasta palautuneesta.com.

